
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。(ClO2中氯元素的化合价为+4价)
(1)浓盐酸在反应中表现出来的性质是_______(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)产生0.1molCl2,则转移电子的物质的量为________mol。
(3)用双线桥表示这个反应电子的转移情况2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
_____________________________
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,某同学向100mL H2S饱和溶液中通入SO2 , 所得溶液pH变化如图所示.下列分析中正确的是( ) 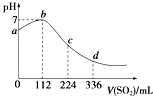
A.b点对应的溶液导电性最强
B.亚硫酸是比氢硫酸更弱的酸
C.ab段反应是SO2+2H2S═3S↓+2H2O
D.原H2S溶液的物质的量浓度为0.05molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水。下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是

A. a-b时沉淀的物质的量:Al(OH)3比BaSO4多
B. d-e时溶液中离子的物质的量:Ba2+可能等于OH-
C. a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D. c-d时溶液中离子的物质的量:AlO2-比Ba2+少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)室温下,0.1 mol/L NaClO溶液的pH0.1 mol/L Na2SO3溶液的pH. (选填“大于”、“小于”或“等于”).浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣ 浓度从大到小的顺序为 .
已知:H2SO3 K1=1.54×10﹣2 K2=1.02×10﹣7 HClO K1=2.95×10﹣8
H2CO3 K1=4.3×10﹣7 K2=5.6×10﹣11
(2)用标准碘溶液滴定容有SO2的水溶液,以测定水中SO2的含量,应选用作指示剂,达到滴定终点的现象是 .
(3)常温下,将amol/lCH3COONa溶于水配成溶液,向其中滴加等体积bmolL﹣1的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离平衡常数Ka= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类、油脂和蛋白质是的说法中,正确的是( )
A. 葡萄糖和蔗糖都能发生水解反应
B. 油脂有油和脂肪之分,但都属于酯
C. 糖类、油脂、蛋白质都是由C、H、O、N四种元素组成
D. 淀粉与纤维素的分子式同为(C6H10O5)n,两者互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知32 g X与40 g Y恰好完全反应,生成m g Q和 9 g H,在相同条件下,16 g X和足量Y混合生成0.25 mol Q和若干摩的H,则物质Q的摩尔质量应是( )
A. 122 g·mol-1 B. 63 g·mol-1 C. 126 g·mol-1 D. 163 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既不是氧化剂也不是还原剂等。下列反应与C+H2O(g)![]() CO+H2相比较,水的作用相同的是 ( )
CO+H2相比较,水的作用相同的是 ( )
A. 3NO2+H2O=2HNO3+NO B. Na2O+H2O=2NaOH
C. 2F2+2H2O=4HF+O2 D. 3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是化学反应原理的重要组成部分.请回答下列问题:
(1)已知一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)△H<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件). 
(2)探究反应条件对0.l0mol/L,Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如表:
编号 | 反应温度/℃ | Na2S2O3浓液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
① | 25℃ | 10.0 | 0 | 10.0 | |
② | 25℃ | 5.0 | a | 10.0 | |
③ | 45℃ | 10.0 | 0 | 10.0 |
上述实验①③是探究对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为 , a为;乙是实验需要测量的物理量,则表格中“乙”为 .
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大. ①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入(填字母序号).
A.硫酸钾B.氯化锰c.硫酸锰D.水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.共价化合物中可能含有离子键
B.Ca2+、K+、Cl﹣、S2﹣四种粒子的离子半径依次减小
C.![]() Po、
Po、 ![]() Po、
Po、 ![]() Po三种原子的核外电子数分别为124、125、126
Po三种原子的核外电子数分别为124、125、126
D.第ⅥA族元素氧、硫、硒对应的氢化物H2O、H2S、H2Se的稳定性依次减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com