
【题目】下列关于糖类、油脂和蛋白质是的说法中,正确的是( )
A. 葡萄糖和蔗糖都能发生水解反应
B. 油脂有油和脂肪之分,但都属于酯
C. 糖类、油脂、蛋白质都是由C、H、O、N四种元素组成
D. 淀粉与纤维素的分子式同为(C6H10O5)n,两者互为同分异构体
科目:高中化学 来源: 题型:
【题目】有一包NaHCO3和KHCO3的混合物样品.某研究性学习小组对其进行了如下探究,请按要求完成下列探究报告.
(1)【探究目的】实验测定样品中NaHCO3和KHCO3物质的量之比. 【探究思路】设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质的量之比.
【实验探究】实验装置如图甲所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).
如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积为mL.写出锥形瓶中反应的离子方程式 .
【结果处理】锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体体积(已换算成标准状况)与加入的稀硫酸的体积关系如图乙所示: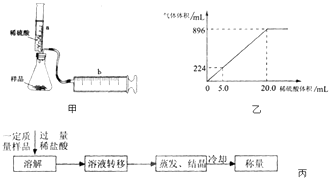
实验所用稀硫酸中溶质的物质的量浓度是mol/L.
(2)样品中NaHCO3和KHCO3物质的量之比为 . 【拓展探究】某同学设计了另一种方案,其操作流程如图丙:在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHCO3和KHCO3物质的量之比(选填“偏大”、“偏小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1molL﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示. 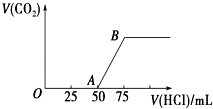
(1)写出OA段所发生反应的离子方程式: .
(2)NaOH在吸收CO2后,所得溶液的溶质为 , 其物质的量浓度之比为 .
(3)产生的CO2体积(标准状况下)为 .
(4)原NaOH溶液的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用原电池理论解释的是( )
A、铝片不用特殊方法保存
B、生铁比纯铁易生锈
C、制氢气时用粗锌而不用纯锌
D、工程施工队在铁制水管外刷一层“银粉”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2+8H2O) 甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)
序号 | A溶液 | B溶液 |
① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是探究对化学反应速率的影响.
(2)分液漏斗中A溶液应该加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是 . 乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/ml | 10 | 5 | 0 | X |
0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
时间/s | 40 | 20 | 10 | ﹣﹣﹣ |
(4)X= A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是 . 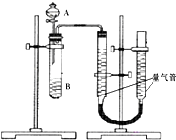
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。(ClO2中氯元素的化合价为+4价)
(1)浓盐酸在反应中表现出来的性质是_______(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)产生0.1molCl2,则转移电子的物质的量为________mol。
(3)用双线桥表示这个反应电子的转移情况2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知相同条件下,下列反应的焓变和乎衡常数分别表示为: ①2H2O(g)=O2(g)+2H2(g)△H1 K1=x
②Cl2(g)+H2(g)=2HCl(g)△H2 K2=y
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3 K3=x
则下列关系正确的是( )
A.△H3=△H1+2△H2 x=xy2
B.H3=△H1+△H2 z=x+y
C.H3=△H1+2△H2 x=x﹣y2
D.H3=△H1+△H2 z= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请预测有机物丙烯酸(CH2=CH-COOH)的发生的反应类型可能有( )
①加成反应②水解反应③酯化反应④中和反应⑤氧化反应.
A. 只有①③B. 只有①③④C. ①②③④⑤D. 只有①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需1 mol·L-1的CuSO4溶液750 mL,配制时应选用的容量瓶的规格和称取CuSO4固体的质量分别为
A. 容量瓶:500 mL、250 mL各一个; CuSO4:共120.0 g
B. 容量瓶:750 mL、 CuSO4:120.0 g
C. 容量瓶:1 000 mL、CuSO4晶体:250.0 g
D. 容量瓶:1 000 mL、 CuSO4:160.0 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com