
| 化学式 | CH3COOH | H2CO3 | HClO | H2C4H4O6(酒石酸) | H2SO3 |
| 电离平衡常数 | 2.0×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 | K1=1.3×10-2 K2=6.3×10-8 |
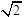 ×10-3,PH=2.85;(3)根据题给信息知,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,发生的反应为:
×10-3,PH=2.85;(3)根据题给信息知,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,发生的反应为:

科目:高中化学 来源:不详 题型:填空题
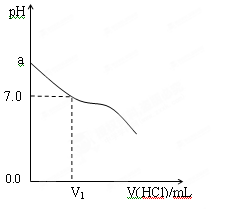
| 组别 | NH3·H2O | HCl | 混合溶液的pH值 |
| 甲 | c(NH3·H2O)=0.1mol·L-1 | c(HCl)=0.1mol·L-1 | pH=a |
| 乙 | NH3·H2O的pH=12 | HCl的pH=2 | pH=b |
| 丙 | c(NH3·H2O)="A" mol·L-1 | c(HCl)=0.1mol·L-1 | pH=c |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe2+、Na+、Cl―、NO3― | B.Ba2+、Al3+、Cl―、NO3― |
| C.K+、Na+、HCO3―、Cl― | D.AlO2-、K+、OH―、Cl― |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe2+、Fe3+、NH4+、NO3- | B.S2-、K+、I-、SO32- |
| C.Na+、I-、CO32-、NO3- | D.Al3+、HCO3-、OH-、Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Na+、Al3+、Cl-、 | B.Cu2+、Cl-、 、OH- 、OH- |
C.Ca2+、Na+、 、 、 | D.H+、 、 、 、OH- 、OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+ |
| B.一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+ |
| C.c (Clˉ) 为 4.00 mol·L-1,c (Al3+) 为1.00 mol·L-1 |
| D.c (Mg2+) 为 1.00 mol·L-1,c(Na+ ) 为 0.50 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验内容 | 实验目的 |
| A | 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同条件下,溶解度Mg(OH)2>Fe(OH)3 |
| B | 向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中NaOH含量 |
| C | 两种一元碱溶液X和Y(X的pH比Y大l),分别加水稀释l00倍后,pH相等 | 证明稀释前c(X)=10c(Y) |
| D | 测定等物质的量浓度的HF与HCl溶液的pH,后者较小 | 证明非金属性Cl>F |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
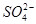 、
、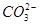 、NH+ 4、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
、NH+ 4、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中| A.NH+ 4Fe3+一定存在, K+可能存在 |
| B.Cl?一定存在,且c(Cl?)≤0.4 mol/L |
C.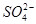 、NH+ 4Fe3+一定存在,且物质的量浓度均为0.02 mol/L 、NH+ 4Fe3+一定存在,且物质的量浓度均为0.02 mol/L |
D.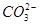 、Al3+一定不存在,K+一定存在 、Al3+一定不存在,K+一定存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com