
【题目】合理的利用吸收工业产生的废气CO2可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
①写出甲醇的官能团名称____________。
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(l) △H=-49.0kJmol-1;一定条件下,向体积固定为1 L的密闭容器中充入1mol CO2和3mol H2 ,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。
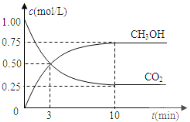
②反应开始至第3分钟时,反应速率v(H2)=________mol/(L·min)。
③该条件下,该反应的平衡常数表达式为________,CO2的平衡转化率是________;
(2)用CO2合成二甲醚(CH3OCH3)。
①CO2 催化加氢合成二甲醚的过程中主要发生下列反应:
反应I:CO2(g) + H2(g)CO(g) + H2O(g) H= +41.2 kJmol-1
反应II: 2CO2(g) + 6H2(g)CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1
其中,反应II 分以下a、b两步完成,请写出反应a的热化学方程式。
a._________
b.2CH3OH(g)CH3OCH3(g) + H2O(g) H = -23.5 kJmol-1
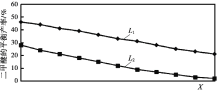
②L(L1、L2)、X分别代表压强或温度,下图表示L一定时,反应II中二甲醚的平衡产率随X变化的关系,其中X代表的物理量是______。判断L1、L2的大小,并简述理由:________。
(3) 恒压时,在CO2和H2起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性(CH3OCH3的选择性=![]() )随温度变化如下图。
)随温度变化如下图。
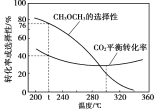
①t℃时,起始投入a molCO2,b mol H2,达到平衡时反应II消耗的H2的物质的量为______mol。
②温度高于300℃,CO2平衡转化率随温度升高而增大的原因是_________。
【答案】羟基 0.5 ![]() 75% CO2(g) + 3H2 (g)CH3OH(g) + H2O(g) H = - 49.5 kJmol-1 温度 L1>L2。反应II是气体化学计量数减少的反应,当温度一定时,增大压强,平衡正向移动,二甲醚平衡产率增大 3a×40%×76% 反应I的H>0,反应II的H<0 ,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅
75% CO2(g) + 3H2 (g)CH3OH(g) + H2O(g) H = - 49.5 kJmol-1 温度 L1>L2。反应II是气体化学计量数减少的反应,当温度一定时,增大压强,平衡正向移动,二甲醚平衡产率增大 3a×40%×76% 反应I的H>0,反应II的H<0 ,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅
【解析】
(1)①甲醇的结构简式是CH3OH;
②根据υ=![]() 计算
计算
③转化率=![]() ;
;
(2) ①根据盖斯定律计算反应a的热化学方程式;
②2CO2(g) + 6H2(g)CH3OCH3(g) + 3H2O(g)正反应放热,升高温度,平衡逆向移动;2CO2(g) + 6H2(g)CH3OCH3(g) + 3H2O(g)正反应气体系数和减小,增大压强,平衡正向移动;
(3) ①根据CH3OCH3的选择性=![]() 计算反应II消耗的H2的物质的量;
计算反应II消耗的H2的物质的量;
②反应I的H>0,温度升高使CO2转化为CO的平衡转化率上升;
(1)①甲醇的结构简式是CH3OH,甲醇含有官能团的名称是羟基;
②根据图象,反应开始至第3分钟时,CO2浓度变化量是0.5mol/L,则氢气浓度变化量是1.5mol/L,υ=![]() 0.5 mol/(L·min);
0.5 mol/(L·min);
③该条件下,CO2(g)+3H2(g)CH3OH(g)+H2O(l)反应的平衡常数表达式为![]() ,CO2的平衡转化率=
,CO2的平衡转化率=![]() 75%;
75%;
(2) ①反应II: 2CO2(g) + 6H2(g)CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1;
根据盖斯定律(II-b)×![]() 得CO2(g) + 3H2 (g)CH3OH(g) + H2O(g) H= - 49.5 kJmol-1;
得CO2(g) + 3H2 (g)CH3OH(g) + H2O(g) H= - 49.5 kJmol-1;
②2CO2(g) + 6H2(g)CH3OCH3(g) + 3H2O(g)正反应放热,升高温度,平衡逆向移动;2CO2(g) + 6H2(g)CH3OCH3(g) + 3H2O(g)正反应气体系数和减小,增大压强,平衡正向移动;由图象可知,随X的增大,CH3OCH3的产率减小,说明平衡逆向移动,所以X表示温度;则L1、L2分别代表不同压强下CH3OCH3的产率,反应II是气体化学计量数减少的反应,当温度一定时,增大压强,平衡正向移动,二甲醚平衡产率增大,则L1>L2;
(3) CH3OCH3的选择性=![]() ,t℃时,CH3OCH3的选择性是76%,CO2的平衡转化率为40%,则
,t℃时,CH3OCH3的选择性是76%,CO2的平衡转化率为40%,则![]() =76%,CH3OCH3的物质的量是
=76%,CH3OCH3的物质的量是![]() mol,反应II消耗的H2的物质的量是
mol,反应II消耗的H2的物质的量是![]() =3a×40%×76%;
=3a×40%×76%;
②反应I的H>0,反应II的H<0 ,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅,所以温度高于300℃,CO2平衡转化率随温度升高而增大。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]=1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. Zn(OH)2溶于水形成的饱和溶液中c(Zn2+)>1.0×10-6 mol·L-l
B. HCOO-的水解常数为1.0×10-10
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O的平衡常数K=100
=Zn2++2HCOO-+2H2O的平衡常数K=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
A. 图 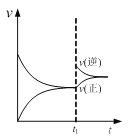 可表示N2+3H2
可表示N2+3H2![]() 2NH3的速率时间图像,t1时刻改变的条件是升高温度
2NH3的速率时间图像,t1时刻改变的条件是升高温度
B. 图 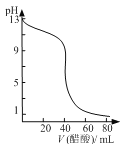 可表示用0.1000 mol·L-1醋酸滴定40.00mL 0.1000mol·L-1NaOH溶液得到的滴定曲线
可表示用0.1000 mol·L-1醋酸滴定40.00mL 0.1000mol·L-1NaOH溶液得到的滴定曲线
C. 图 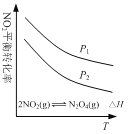 可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2
可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2
D. 图 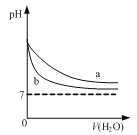 可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示的实验操作,不能实现相应实验目的的是
A.鉴别甲苯与己烷 | B.实验室制备乙酸乙酯 | C.检验电石与饱和食盐水的产物乙炔 | D. 比较乙酸、碳酸与苯酚酸性强弱 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析正确的是( )

A. HR为强酸 B. a、b两点所示溶液中水的电离程度相同
C. b点溶液中c(NH![]() )>c(R-)、c(OH-)>c(H+) D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
)>c(R-)、c(OH-)>c(H+) D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.某盐是一种重要的化工原料,在印染、制革、木材和农业等领域有重要用途,其溶液可能含有NH4+、Al3+、SO42-、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:
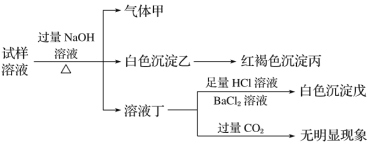
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定有NH4+、SO42-和Fe2+
B.试样中一定没有Al3+
C.若气体甲在标准状况下体积为0.448 L,沉淀丙和沉淀戊分别为1.07 g和4.66 g,则可判断溶液中还有Cl-
D.该盐工业上可以用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室研究锌与酸的反应,实验数据如下:
实验序号 | 锌质量 | 锌状态 | c(H2SO4) | V(H2SO4) | 金属消失时间 |
1 | 0.10 g | 颗粒 | 0.5mol·L-1 | 50mL | 500s |
2 | 0.10 g | 粉末 | 0.5mol·L-1 | 50mL | 50s |
3 | a g | 颗粒 | 1.0mol·L-1 | 50mL | 125s |
分析上述数据,回答下列问题
(1)实验1和2表明,_____对反应速率有影响。
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a =________ g。
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如下图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。

该同学对产生这一现象的原因,提出两种假设:
a. 氯离子对反应起促进作用,加快了反应的进行;
b. ________,减缓了反应的进行。
为进一步证实自己的猜想,该同学在室温下,分别取5mL 0.2 mol·L-1盐酸溶液,一份加入一定量的固体___________ (填“所加试剂化学式”),另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小。
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是___ (结合化学方程式作出合理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明亚硝酸是弱电解质的是
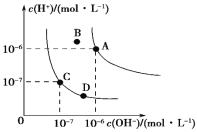
①亚硝酸溶液中存在HNO2分子,呈酸性
②用HNO2溶液做导电性实验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应
④0.1 mol·L-1 HNO2溶液中,c(H+)=0.015 mol·L-1
⑤向水中加入亚硝酸钠固体,如图水的电离平衡曲线可以从C点到D点
A.①②③B.②③④C.①②④⑤D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有较广泛的抑菌作用,其结构简式如图。下列关于咖啡酸的说法不正确的是
![]()
A.分子中含有2种含氧官能团
B.能与FeCl3溶液发生显色反应
C.1mol咖啡酸最多能与3molBr2反应
D.1 mol咖啡酸最多能与3molNaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com