
【题目】有短周期元素A,B,C,D,E,
已知:①常温下,A元素的单质在空气或浓硫酸中,表面都能生成致密的氧化膜;
②B元素的原子序数比A元素大,其原子的次外层的电子数是最外层电子数的2倍;
③E与A同周期,C,D,E三种元素形成的单质或化合物可发生如图所示的反应.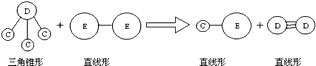
请回答下列问题:
(1)写出A元素最高价氧化物与NaOH溶液反应的离子方程式:;
(2)D元素的原子结构示意图是:;
(3)B元素与E元素的最高价氧化物的水化物的酸性强弱(用化学式表示):>;
(4)请用化学方程式表示E元素的单质在工业上的一种重要用途: .
【答案】
(1)Al2O3+2OH﹣═2AlO2﹣+H2O
(2)![]()
(3)HClO4;H2SiO3
(4)2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
【解析】解:短周期元素A、B、C、D、E,①常温下,A元素的单质在空气或浓硫酸中,表面都能生成致密的氧化膜,则A为Al元素;②B元素的原子序数比A元素大,B处于第三周期,B原子的次外层的电子数是最外层电子数的2倍,最外层电子数为4,则B为Si元素;③E与A同周期,E的单质为双原子分子,通过单键形成,则E为Cl元素,D与C形成DC3 , 为三角锥型结构,D的单质通过三键形成的双原子分子,则D为氮元素、C为氢元素,(1)A元素最高价氧化物为Al2O3 , 与NaOH溶液反应的离子方程式为:Al2O3+2OH﹣═2AlO2﹣+H2O,所以答案是:Al2O3+2OH﹣═2AlO2﹣+H2O;(2)C为N元素,原子结构示意图为: ![]() ,所以答案是:
,所以答案是: ![]() ;处于元素周期表中第二周期第ⅤA族,所以答案是:二、ⅤA;(3)B元素与E元素的最高价氧化物的水化物分别为H2SiO3、HClO4 , 硅酸为弱酸,高氯酸为强酸,酸性:HClO4>H2SiO3 , 所以答案是:HClO4>H2SiO3;(4)氯气在工业上可以用于制备漂白粉等,反应方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,所以答案是:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
;处于元素周期表中第二周期第ⅤA族,所以答案是:二、ⅤA;(3)B元素与E元素的最高价氧化物的水化物分别为H2SiO3、HClO4 , 硅酸为弱酸,高氯酸为强酸,酸性:HClO4>H2SiO3 , 所以答案是:HClO4>H2SiO3;(4)氯气在工业上可以用于制备漂白粉等,反应方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,所以答案是:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.


科目:高中化学 来源: 题型:
【题目】实验探究:探究碳、硅元素的非金属性的相对强弱.根据要求完成下列各小题.
(1)实验装置: 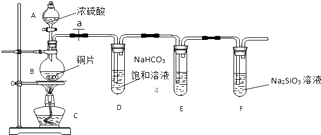
填写所示仪器名称AB
(2)实验步骤:
连接仪器、、加药品后,打开a、然后滴入浓硫酸,加热.
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是;装置E中足量酸性KMnO4溶液(具有强氧化性)的作用是;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性(填“能”或“否”),试管D中发生反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②碘的CCl4溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A. 萃取、蒸发、分液 B. 分液、蒸馏、萃取
C. 分液、萃取、蒸馏 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表列出了A~R九种元素在周期表的位置:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | E | R | F | |||||
3 | A | C | D | H | I | G | ||
4 | B |
(1)写出R单质分子的电子式 .
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是(填化学式).
(3)A,B,C三种元素的阳离子按离子半径由大到小的顺序排列为 . (用元素的离子符号表示).
(4)写出A的单质与水反应的离子方程式 .
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g,X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应,X的元素符号是 , 它位于元素周期表中位置:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( ) 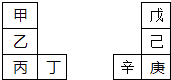
A.金属性:甲>乙>丁
B.原子半径:辛>戊>甲
C.丙与庚的元素原子核外电子数相差13
D.形成的最简单氢化物的稳定性:己>戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验发现,298 K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是( )

A. 该原电池的正极反应是Zn-2e-==Zn2+
B. 该电池总反应为3Zn+2Fe3+==2Fe+3Zn2+
C. 该电池铂电极上有气泡出现
D. 左烧杯中溶液的血红色逐渐褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
(1)①将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈;与盐酸反应的速度最慢;与盐酸反应产生的气体最多.
②向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为 .
(2)利用图装置可验证同主族元素非金属性的变化规律 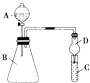
①仪器B的名称为 , 干燥管D的作用为防止 .
②若要证明非金属性:Cl>I,则A中加浓盐 酸,B中加KMnO4 , (KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为 , 即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com