
����Ŀ��ʵ��̽����̽��̼����Ԫ�صķǽ����Ե����ǿ��������Ҫ��������и�С�⣮
��1��ʵ��װ�ã� 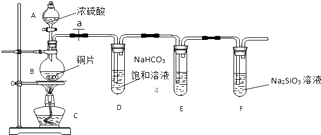
��д��ʾ��������AB
��2��ʵ�鲽�裺
��������������ҩƷ��a��Ȼ�����Ũ���ᣬ���ȣ�
��3������̽��������֪����ǿ���������̼�ᣩ
��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ����װ��E����������KMnO4��Һ������ǿ�����ԣ�����������
����˵��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ��ʵ����������
�������Թ�D�е�ʵ�������ܷ�֤����Ԫ�صķǽ�����ǿ��̼Ԫ�صķǽ���������ܡ������Թ�D�з�����Ӧ�����ӷ���ʽ�� ��
���𰸡�
��1����Һ©����Բ����ƿ
��2�����װ�õ�������
��3��Cu+2H2SO4��Ũ�� ![]() ?CuSO4+SO2��+2H2O����ȥSO2���壻ʢ��Na2SiO3��Һ���Թ��г��ְ�ɫ��������SO2+2HCO3��=SO32��+H2O+2CO2
?CuSO4+SO2��+2H2O����ȥSO2���壻ʢ��Na2SiO3��Һ���Թ��г��ְ�ɫ��������SO2+2HCO3��=SO32��+H2O+2CO2
���������⣺��1������װ��ͼ�е�������֪AΪ��Һ©����BΪԲ����ƿ�����Դ��ǣ���Һ©����Բ����ƿ����2����Ӧ�������壬�ڼ���ҩƷ֮ǰ��Ҫ����װ�õ������ԣ���ֹ�����Բ��õ�������й©�����Դ��ǣ����װ�õ������ԣ���3�����ڼ���������ͭ��Ũ���ᷴӦ���ɶ�����������ͭ��ˮ���䷴Ӧ����ʽΪ��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O������Ķ�������������KMnO4��Һ���գ���ֹ���ź�������飬���Դ��ǣ�Cu+2H2SO4��Ũ��
CuSO4+SO2��+2H2O������Ķ�������������KMnO4��Һ���գ���ֹ���ź�������飬���Դ��ǣ�Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O����ȥSO2���壻�ڶ�����̼��Na2SiO3��Һ��Ӧ���ɹ��ᣬ֤����̼�����Աȹ���ǿ��˵��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ������ʢ��Na2SiO3��Һ���Թ��г��ְ�ɫ������˵��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ�����Դ��ǣ�ʢ��Na2SiO3��Һ���Թ��г��ְ�ɫ��������������ۺ����������ǿ���жϷǽ�����ǿ����������������ˮ���ɵ��������ᣬ������ۺ����ᣬ���Բ����жϷǽ�����ǿ�����Թ�D�з�����Ӧ�Ƕ���������̼���������ɶ�����̼�������ӷ���ʽΪ��SO2+2HCO3��=SO32��+H2O+2CO2 �� ���Դ��ǣ���SO2+2HCO3��=SO32��+H2O+2CO2 ��
CuSO4+SO2��+2H2O����ȥSO2���壻�ڶ�����̼��Na2SiO3��Һ��Ӧ���ɹ��ᣬ֤����̼�����Աȹ���ǿ��˵��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ������ʢ��Na2SiO3��Һ���Թ��г��ְ�ɫ������˵��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ�����Դ��ǣ�ʢ��Na2SiO3��Һ���Թ��г��ְ�ɫ��������������ۺ����������ǿ���жϷǽ�����ǿ����������������ˮ���ɵ��������ᣬ������ۺ����ᣬ���Բ����жϷǽ�����ǿ�����Թ�D�з�����Ӧ�Ƕ���������̼���������ɶ�����̼�������ӷ���ʽΪ��SO2+2HCO3��=SO32��+H2O+2CO2 �� ���Դ��ǣ���SO2+2HCO3��=SO32��+H2O+2CO2 ��
�����㾫�����������⣬������Ҫ�˽�ǽ�����Ԫ�����ڱ��е�λ�ü������ʵݱ�Ĺ���(��Ŀǰ��֪��112��Ԫ���У��ǽ���Ԫ����22�֣���H��ǽ���Ԫ�ض�λ�����ڱ������Ϸ���H�����Ϸ�����F�Ƿǽ�������ǿ��Ԫ��)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ�������ʳƷ����������������ʳƷ���������(����)
A. �ռ� B. ��ʯ�� C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ�����ڷֱ��ǴӺ���Һ�ij�ֿ�ʯ����ȡ�����Ҫ��Ӧ������˵����ȷ���ǣ� ��
�� 2NaI��MnO2��3H2SO4=2NaHSO4��MnSO4��2H2O��I2��
��2NaIO3��5NaHSO3= 2Na2SO4��3NaHSO4��H2O��I2
A. ������Ӧ��NaHSO4��Ϊ��������
B. ��Ԫ���ڷ�Ӧ���б���ԭ���ڷ�Ӧ���б�����
C. �����ԣ�MnO2>SO![]() >IO
>IO![]() >I2
>I2
D. ��Ӧ�����������ɵ�����I2ʱת�Ƶ�������Ϊ1��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʾΪԪ�����ڱ���һ���֣�����Ԫ�آ١����ڱ��е�λ�ã���ش��������⣺ 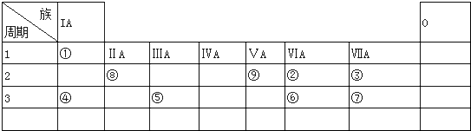
��1�����ڱ���Ԫ�������������ͼ۴�����Ϊ������壨������ű�ʾ����
��2���͢ߵ���ۺ����������ǿ��Ϊ������Ļ�ѧʽ��ʾ����
��3���١�������Ԫ�ذ�ԭ�Ӹ���֮��Ϊ1��1��ɵij���Һ̬�������������Һ���ܽ�Fe2+������д���÷�Ӧ�����ӷ���ʽ��
��4����֪���ڱ��д��ڶԽ����ƹ������루Be��������ѧ�������ƣ�����������������Ҳ�����ԣ�д���������������ܵ�����������ˮ���ﷴӦ�Ļ�ѧ����ʽ ��
��5����֪W+X=Y+Z����Ӧ��Ҫ���ȣ�����W��X��Y��Z�ֱ����ɢ٢ڢ�����Ԫ���γɵ�����ʮ�������ӣ�W��XΪ���ӣ�Y��ZΪ���ӣ���д���û�ѧ����ʽ ��
��6���ɱ���Ԫ���γɵ����ʿɷ�����ͼ�еķ�Ӧ������B��C��G�ǵ��ʣ�BΪ����ɫ���壬D��Һ�Լ��ԣ� 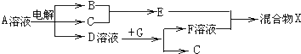
��д��D��Һ��G��Ӧ�Ļ�ѧ����ʽ ��
��д������A��Һ�����ʵ������ӵķ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����л����У�һ������ͬϵ����ǣ� ��
A.C2H4��C2H2B.C2H2��C6H6
C.C3H8��C5H12D.C2H4��C4H8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ������ ��
A. 1mol���������������Ʒ�Ӧ�ܲ���2.5mol H2
B. a gij�����к�������Ϊb��c g�������ڱ���µ����Ϊ(22.4bc)/(aNA)
C. ��1molCl2ͨ�뵽ˮ�У���N(HClO)+N(Cl-)+N(ClO-) =2NA(N��ʾ��������
D. ��ͬ������Na2O2��Na2S���������ͬ��������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ᴿ��ʵ���У����в�����ȷ����( )
A. ����ʱ�ò���������©���ڵ�Һ�壬�Լ��ٹ���
B. ��������������ʱ����Ҫ�ò���������
C. ���������г��ֽ϶�������ʱ��Ӧֹͣ����
D. ����Һ���ɺ�ֹͣ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ж�����Ԫ��A��B��C��D��E��
��֪���ٳ����£�AԪ�صĵ����ڿ�����Ũ�����У����涼���������ܵ�����Ĥ��
��BԪ�ص�ԭ��������AԪ�ش���ԭ�ӵĴ����ĵ�������������������2����
��E��Aͬ���ڣ�C��D��E����Ԫ���γɵĵ��ʻ���ɷ�����ͼ��ʾ�ķ�Ӧ��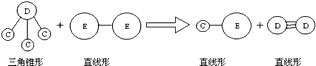
��ش��������⣺
��1��д��AԪ�������������NaOH��Һ��Ӧ�����ӷ���ʽ����
��2��DԪ�ص�ԭ�ӽṹʾ��ͼ�ǣ���
��3��BԪ����EԪ�ص�����������ˮ���������ǿ�����û�ѧʽ��ʾ��������
��4�����û�ѧ����ʽ��ʾEԪ�صĵ����ڹ�ҵ�ϵ�һ����Ҫ��;�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������������仯����( )
A. ��н��̿ B. ��Ƴɴ� C. ��ɫ��Ӧ D. �����ɸ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com