
����Ŀ�������ʾΪԪ�����ڱ���һ���֣�����Ԫ�آ١����ڱ��е�λ�ã���ش��������⣺ 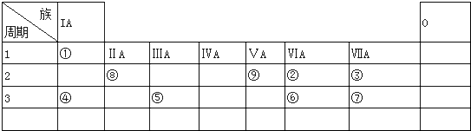
��1�����ڱ���Ԫ�������������ͼ۴�����Ϊ������壨������ű�ʾ����
��2���͢ߵ���ۺ����������ǿ��Ϊ������Ļ�ѧʽ��ʾ����
��3���١�������Ԫ�ذ�ԭ�Ӹ���֮��Ϊ1��1��ɵij���Һ̬�������������Һ���ܽ�Fe2+������д���÷�Ӧ�����ӷ���ʽ��
��4����֪���ڱ��д��ڶԽ����ƹ������루Be��������ѧ�������ƣ�����������������Ҳ�����ԣ�д���������������ܵ�����������ˮ���ﷴӦ�Ļ�ѧ����ʽ ��
��5����֪W+X=Y+Z����Ӧ��Ҫ���ȣ�����W��X��Y��Z�ֱ����ɢ٢ڢ�����Ԫ���γɵ�����ʮ�������ӣ�W��XΪ���ӣ�Y��ZΪ���ӣ���д���û�ѧ����ʽ ��
��6���ɱ���Ԫ���γɵ����ʿɷ�����ͼ�еķ�Ӧ������B��C��G�ǵ��ʣ�BΪ����ɫ���壬D��Һ�Լ��ԣ� 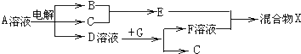
��д��D��Һ��G��Ӧ�Ļ�ѧ����ʽ ��
��д������A��Һ�����ʵ������ӵķ��� ��
���𰸡�
��1��IVA
��2��HClO4��H2SO4
��3��H2O2+2Fe2++2H+=2Fe3++2H2O
��4��Be��OH��2+2NaOH=Na2BeO2+2H2O
��5��NH4++OH�� ![]() NH3��+H2O
NH3��+H2O
��6��2Al+2NaOH+2H2O=2NaAlO2+3H2����ȡ����A��Һ�μӼ���ϡ�����ữ����������Һ�а�ɫ��������
���������⣺����Ԫ�������ڱ��е�λ�ã���֪��ΪH����ΪO����ΪF����ΪNa����ΪAl����ΪS����ΪCl����ΪBe����ΪN����1�����ڱ���Ԫ�������������ͼ۴�����Ϊ���Ԫ��λ��IVA�����Դ��ǣ�IVA����2���ǽ�����Cl��S���ǽ�����Խǿ����ۺ����������Խǿ�������ԣ�HClO4��H2SO4 �� ���Դ��ǣ�HClO4��H2SO4����3���١�������Ԫ�ذ�ԭ�Ӹ���֮��Ϊ1��1��ɵij���Һ̬������ΪH2O2 �� ��������Һ���ܽ�Fe2+����Fe3+ �� ͬʱ����ˮ����Ӧ���ӷ���ʽΪ��H2O2+2Fe2++2H+=2Fe3++2H2O�����Դ��ǣ�H2O2+2Fe2++2H+=2Fe3++2H2O����4���������������ǿ�Ӧ�����κ�ˮ����Ӧ�Ļ�ѧ����ʽΪBe��OH��2+2NaOH=Na2BeO2+2H2O�����Դ��ǣ�Be��OH��2+2NaOH=Na2BeO2+2H2O����5����֪W+X=Y+Z��W��X��Y��Z�ֱ����ɢ٢ڢ�����Ԫ���γɵ�����ʮ�������ӣ�Ӧ��Ϊ笠����������������ӵķ�Ӧ���÷�ӦʽΪNH4++OH�� ![]() NH3��+H2O�����Դ��ǣ�NH4++OH��
NH3��+H2O�����Դ��ǣ�NH4++OH�� ![]() NH3��+H2O����6���ɱ���Ԫ���γɵ����ʣ�����B��C��G�ǵ��ʣ�BΪ����ɫ���壬��BΪCl2 �� D��Һ�Լ��ԣ����A��ҺΪ����Ȼ�����Һ�����������������������ƣ���DΪNaOH��CΪH2 �� ��EΪHCl��G��������������Һ��Ӧ�õ��õ�������F����GΪAl��FΪNaAlO2 �� ��D��Һ��G��Ӧ�Ļ�ѧ����ʽΪ��2Al+2NaOH+2H2O=2NaAlO2+3H2�������Դ��ǣ�2Al+2NaOH+2H2O=2NaAlO2+3H2�����ڼ���NaCl��Һ�����ʵ������ӵķ�����ȡ����A��Һ�μӼ���ϡ�����ữ����������Һ�а�ɫ�������ɣ����Դ��ǣ�ȡ����A��Һ�μӼ���ϡ�����ữ����������Һ�а�ɫ�������ɣ�
NH3��+H2O����6���ɱ���Ԫ���γɵ����ʣ�����B��C��G�ǵ��ʣ�BΪ����ɫ���壬��BΪCl2 �� D��Һ�Լ��ԣ����A��ҺΪ����Ȼ�����Һ�����������������������ƣ���DΪNaOH��CΪH2 �� ��EΪHCl��G��������������Һ��Ӧ�õ��õ�������F����GΪAl��FΪNaAlO2 �� ��D��Һ��G��Ӧ�Ļ�ѧ����ʽΪ��2Al+2NaOH+2H2O=2NaAlO2+3H2�������Դ��ǣ�2Al+2NaOH+2H2O=2NaAlO2+3H2�����ڼ���NaCl��Һ�����ʵ������ӵķ�����ȡ����A��Һ�μӼ���ϡ�����ữ����������Һ�а�ɫ�������ɣ����Դ��ǣ�ȡ����A��Һ�μӼ���ϡ�����ữ����������Һ�а�ɫ�������ɣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ���ǣ� ��
A. ��֪2SO2(g)+O2 ![]() 2SO3(g) Ϊ���ȷ�Ӧ����SO2������һ������SO3������
2SO3(g) Ϊ���ȷ�Ӧ����SO2������һ������SO3������
B. ��֪C(ʯī,s)=C(���ʯ,s) ��H��0������ʯ��ʯī�ȶ�
C. ��֪H+(aq)+OH-(aq)=H2O(1),��H=��57.3kJ/mol�����κ�����кͷ�Ӧ����ЧӦ��Ϊ57.3 kJ
D. ��֪2C(s)+2O2(g)=2CO2(g) ��H1��2C(s)+O2(g)=2CO(g) ��H2 ����H1����H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�����������С����
A.��������B.��ҵ�ƾ�C.ʳ��D.������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���2008�걱�����˻����ò����У������л��ϳɲ��ϵ��ǣ� ��
A.������������������������������������
B.���ᱡ��Ʒ�����Ͻ��������˻���������������
C.�úϽ��ǿ�ȸֲ������������������������
D.��ETFEĤ�����ķ���ϩһ��ϩ��������������Ӿ����������ˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����úϳɰ�ʵ���˹��̵������ںϳɰ���Ҫԭ�ϵ���(����)
A. �������� B. ���� C. ̼���� D. �����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������FeCl3��Һ��Fe(OH)3����������ȷ��
A. FeCl3��Һ�ܲ������������Fe(OH)3���岻�ܲ������������
B. FeCl3��Һ���ܲ������������Fe(OH)3�����ܲ������������
C. ���߶��ܲ������������
D. ���߶����ܲ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��̽����̽��̼����Ԫ�صķǽ����Ե����ǿ��������Ҫ��������и�С�⣮
��1��ʵ��װ�ã� 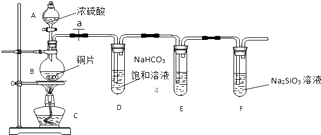
��д��ʾ��������AB
��2��ʵ�鲽�裺
��������������ҩƷ��a��Ȼ�����Ũ���ᣬ���ȣ�
��3������̽��������֪����ǿ���������̼�ᣩ
��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ����װ��E����������KMnO4��Һ������ǿ�����ԣ�����������
����˵��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ��ʵ����������
�������Թ�D�е�ʵ�������ܷ�֤����Ԫ�صķǽ�����ǿ��̼Ԫ�صķǽ���������ܡ������Թ�D�з�����Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�������ͺ��Ȼ�����Һ �����CCl4��Һ ���Ȼ��ƺ͵������ˮ��Һ���������ϸ����Һ����ȷ����������
A. ��ȡ����������Һ B. ��Һ��������ȡ
C. ��Һ����ȡ������ D. ������ȡ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�鷢�֣�298 Kʱ����FeCl3������Һ�м�����п����Fe3+��������ԭ��Fe2+��ij����Ӫ��ȤС����ݸ�ʵ����ʵ�������ͼ��ʾԭ���װ�á������й�˵����ȷ���ǣ�������

A. ��ԭ��ص�������Ӧ��Zn��2e��==Zn2��
B. �õ���ܷ�ӦΪ3Zn��2Fe3+==2Fe��3Zn2+
C. �õ�ز��缫�������ݳ���
D. ���ձ�����Һ��Ѫ��ɫ����ȥ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com