
【题目】实验发现,298 K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是( )

A. 该原电池的正极反应是Zn-2e-==Zn2+
B. 该电池总反应为3Zn+2Fe3+==2Fe+3Zn2+
C. 该电池铂电极上有气泡出现
D. 左烧杯中溶液的血红色逐渐褪去
科目:高中化学 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题: 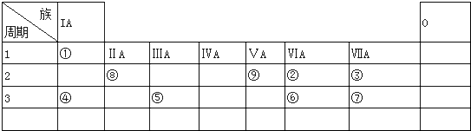
(1)周期表中元素最高正价与最低价代数和为零的是族(用族序号表示).
(2)⑥和⑦的最高价含氧酸的酸性强弱为(用酸的化学式表示).
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式;
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式 .
(5)已知W+X=Y+Z(反应需要加热,),W,X,Y,Z分别是由①②⑨三种元素形成的四种十电子粒子(W,X为离子,Y,Z为分子),写出该化学方程式 .
(6)由表中元素形成的物质可发生如图中的反应,其中B,C,G是单质,B为黄绿色气体,D溶液显碱性. 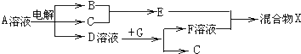
①写出D溶液与G反应的化学方程式 .
②写出检验A溶液中溶质的阴离子的方法 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有短周期元素A,B,C,D,E,
已知:①常温下,A元素的单质在空气或浓硫酸中,表面都能生成致密的氧化膜;
②B元素的原子序数比A元素大,其原子的次外层的电子数是最外层电子数的2倍;
③E与A同周期,C,D,E三种元素形成的单质或化合物可发生如图所示的反应.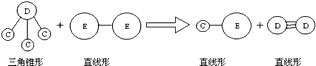
请回答下列问题:
(1)写出A元素最高价氧化物与NaOH溶液反应的离子方程式:;
(2)D元素的原子结构示意图是:;
(3)B元素与E元素的最高价氧化物的水化物的酸性强弱(用化学式表示):>;
(4)请用化学方程式表示E元素的单质在工业上的一种重要用途: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是;2Cu2O+ Cu2S![]() 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。
(1)Cu+的价电子轨道表示式为__________________;Cu2O与Cu2S比较,熔点较高的是_______,原因为_____________________________________。
(2)SO2与SO3的键角相比,键角更大的是____________。将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图1所示。此固态SO3中S原子的杂化轨道类型是_______;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为_________(填图中字母)。
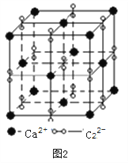
(3)离子化合物CaC2的一种晶体结构如下图2所示。写出该物质的电子式_____。从钙离子看,属于____________堆积;一个晶胞含有的π键平均有______个。
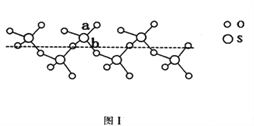

(4)奥氏体是碳溶解在γ—Fe中形成的一种间隙固溶体,无磁性,其晶胞如上图3所示,则该物质的化学式为________,若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为____________________ pm。(阿伏加德罗常数的值用NA表示,写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
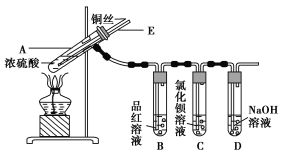
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为 。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是 。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 |
写出其中SO2表现还原性的离子反应方程式: 。
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是 。
(5)实验完毕后,装置中残留的气体有毒,不能打开导管上的胶塞。为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是 。
(6)将SO2气体通入含有n mol Na2S的溶液中,充分反应后,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体 mol(不考虑溶解的SO2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W,X,Y,Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素且其焰色反应为黄色.Y和W的最外层电子数相等.Y,Z两元素原子的质子数之和为W,X两元素质子数之和的3倍且Z的单质为淡黄色固体.由此可知:
(1)写出元素符号W , Z .
(2)W2X的电子式为 .
(3)由Y,X,W组成的化合物中有键和键.
(4)由W,X,Y,Z四种元素组成的化合物的化学式为 , ;写出这两种物质之间反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com