
【题目】改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数φ(X)随pH的变化如图所示。
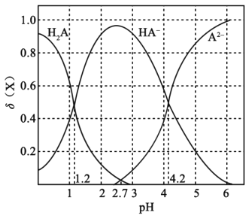
下列叙述错误的是( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
【答案】D
【解析】
由图象可知,pH=1.2时,c(H2A)=c(HA-),pH=2.7时,c(H2A)=c(A2-),pH=4.2时,c(HA-)=c(A2-),随着pH的增大,c(H2A)逐渐减小,c(HA-)先增大后减小,c(A2-)逐渐增大,结合电离平衡常数以及题给数据计算,可根据纵坐标比较浓度大小,以此解答该题。
A.由图象可知pH=1.2时,H2A与HA-的曲线相交,则c(H2A)=c(HA-),A正确;
B.pH=4.2时,c(H+)=10-4.2mol/L,c(HA-)=c(A2-),K2 (H2A)=![]() =10-4.2,则lg[K2(H2A)]=-4.2, B正确;
=10-4.2,则lg[K2(H2A)]=-4.2, B正确;
C.由图象可知,pH=2.7时,c(H2A)=c(A2-),由纵坐标数据可知c(HA-)>c (H2A)=c(A2-),C正确;
D.pH=4.2时,c(HA-)=c(A2-),但此时c (H2A)≈0,如体积不变,则c(HA-)=c(A2-)=0.05molL-1,c(H+)=10-4.2mol/L,如体积变化,则不能确定c(HA-)、c(A2-)与c(H+)浓度大小关系,D错误。
答案为D。


科目:高中化学 来源: 题型:
【题目】常温下,向![]() 浓度均为
浓度均为![]() 和
和![]() 的混合溶液中滴加
的混合溶液中滴加![]() 的
的![]() ,测得混合溶液的电阻率(溶液的电阻率越大,导电能力越弱)与加入氨水的体积
,测得混合溶液的电阻率(溶液的电阻率越大,导电能力越弱)与加入氨水的体积![]() 的关系如图所示(忽略混合时体积变化),下列说法正确的是( )
的关系如图所示(忽略混合时体积变化),下列说法正确的是( )

A.常温下,![]() 的
的![]() 比同浓度
比同浓度![]() 的
的![]() 大
大
B.![]() 过程中水的电离程度先减小后增大
过程中水的电离程度先减小后增大
C.![]() 点溶液中,
点溶液中,![]()
D.![]() 点时,
点时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
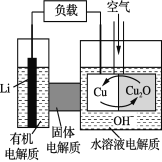
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为元素周期表中前四周期元素,原子序数依次增大,A元素原子核外有3个未成对电子,B元素原子核外电子占用3个能级,其中最高能级上的电子数是其所在能层数的2倍,D元素与B元素同族,C元素与A元素同族,E元素原子的价电子数是其余电子数的一半。
(1)A、C、D的第一电离能由大到小的顺序为___________________(用元素符号表示),E2+的基态电子排布式为__________________________________。
(2)B和D的氢化物中,B的氢化物沸点较高的原因是____________________________。
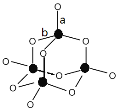
(3)C形成的最高价氧化物的结构如图所示,该结构中C-B键的键长有两类,键长较短的键为__________(填“a”或“b”)。
(4)E可与CO形成羰基配合物E2(CO)8,是有机合成的重要催化剂,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
① E2(CO)8为_________晶体。(填晶体类型)
② E2(CO)8晶体中存在的作用力有______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为碘晶体晶胞结构。有关说法中正确的是( )
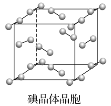
A. 碘晶体为无限延伸的空间结构,是原子晶体
B. 用切割法可知平均每个晶胞中有4个碘原子
C. 碘晶体中的碘原子间存在非极性键和范德华力
D. 碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]聚合硫酸铁(PFS)是水处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。
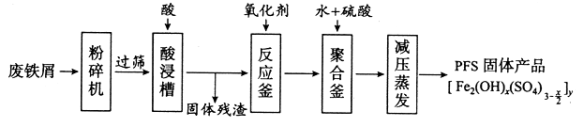
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______。
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
a.KMnO4b.![]() c.
c.![]() d.
d.![]()
(4)聚合釜中溶液的pH必须控制在一定的范围内。pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为![]() (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c![]() 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液![]() ,已知该样品中Fe的质量分数w,则B的表达式为__________。
,已知该样品中Fe的质量分数w,则B的表达式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再变化
d. c(I)=y mol·L1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某菱镁矿主要成分是MgCO3,还含有Al2O3、FeCO3、Fe2O3、SiO2等杂质,由该菱镁矿制备高纯MgO的流程如图。回答下列问题:
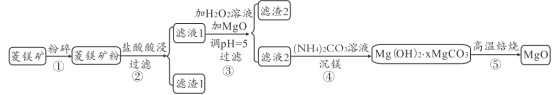
(1)将矿石粉碎的目的是_____,滤渣1的成分是_____
(2)步骤③先加入足量H2O2溶液,再加MgO调节溶液pH=5,加入足量的H2O2溶液后发生的所有氧化还原反应的方程式为_____
(3)滤渣2的成分是_____,1mol该滤渣用3mol/L硫酸溶解,需消耗硫酸_____mL
(4)列举沉镁之后的滤液的一种用途_____,称取14.2g的![]() 在_____(填仪器名称)中进行高温焙烧得到的MgO质量为8.0g,则x=_____。
在_____(填仪器名称)中进行高温焙烧得到的MgO质量为8.0g,则x=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com