
【题目】下图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,其对应的化学式正确的是(图中:O-X,●-Y,⊕-Z。C选项中Y原子在面上。)( )
A. X2Y B. XY3
B. XY3 C. XY3Z
C. XY3Z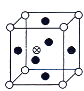 D. XYZ
D. XYZ
科目:高中化学 来源: 题型:
【题目】已知A是一种食品中常见的有机物,在实验室中,气体B能使溴水褪色生成C,物质F的分子式为C4H8O2,是一种有浓郁香味,不易溶于水的油状液体,请根据以下信息回答
相关问题:

请回答:
(1)物质E中的官能团名称为:____________。
(2)物质B与溴水反应生成C的反应类型为:
____________________________________________________________________。
B与E在一定条件下反应生成F的化学方程式为:
____________________________________________________________________。
(4)X是有机物E的同系物,其相对分子质量是74,且化学性质与E相似。下列说法正确的是(_____)
A.有机物E能发生银镜反应 B.有机物A与X反应生成丙酸甲酯
C.甲酸甲酯是X的同分异构体 D.有机物A、D、E均能溶解于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3蚀刻液由FeCl3和盐酸等组成,可用于蚀刻铜及铜合金等。
(1)加入盐酸可抑制Fe3+及生成的Cu2+的水解, Fe3+水解的离子方程式为____。
(2)FeCl3溶液蚀刻铜的化学方程式为____。
(3)测定某废蚀刻液中Cu2+含量的实验步骤如下:量取25.00mL废蚀刻液,加入足量的NH4HF2(掩蔽Fe3+,消除干扰),加入稍过量KI溶液(2Cu2++4I-=2CuI↓+ I2),在暗处静置5min,然后用0.02000mol·L-1Na2S2O3标准溶液滴定(I2+2S2O![]() =2I-+S4O
=2I-+S4O![]() ),接近终点时,加入淀粉和10mL10%NH4SCN溶液(CuI可吸附少量I2, CuSCN不吸附I2),继续滴定至终点,消耗Na2S2O3溶液20.00mL。
),接近终点时,加入淀粉和10mL10%NH4SCN溶液(CuI可吸附少量I2, CuSCN不吸附I2),继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①不加NH4HF2会导致测得的铜的含量____(填:“偏高”“偏低”或“不变”)。
②通过计算确定该废蚀刻液中铜的含量(单位g·L-1,写出计算过程)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如右图所示的装置图:请回答下列问题:
![]()
(1)写出Al和NaOH溶液反应的离子方程式_______________________________。
(2)在点燃H2之前必须先进行____________________________________________。

(3)实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可教师说太危险,你认为产生危险的原因是___________________________。
(4)实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97 g·mL-1、0.88 g·mL-1、1.00 g·mL-1,并据此对实验进行了改进。在改进后的实验中H2的生成速率____________。(填“减慢”或“加快”)
(5)将4.6gNa和8.1gAl投入到足量的水中,所得溶液的体积为200mL,则生成标准状况下的H2的体积是___________?该溶液中溶质的物质的量浓度是__________________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向水中通入氯气:Cl2+H2O===2H+ + ClO+ Cl
B. 向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3+2OH===CaCO3↓+CO32+2H2O
C. 向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2+4NH4++2H2O
D. 将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,下列说法中不正确的是( )
A.合金材料中可能含有非金属元素
B.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
C.马口铁(镀锡)的表面一旦破损,铁腐蚀加快
D.神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中的化学反应方程式是________________(锰被还原为Mn2+)。
②C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有__________________(写离子方程式)。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否为K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由____________________________________产生(用离子方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。
②根据K2FeO4的制备实验得出:氧化性Cl2________FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分:

(1)①表示的元素名称是_________②对应简单离子结构示意图_______。
(2)③位于元素周期表中第________周期,第__________族。
(3)④的单质与 NaOH 溶液反应的离子方程式____________。
(4)⑤在自然界中有质量数为35和37的两种核素,该元素的相对原子质量为35.5,则两核素在自然界中的原子个数之比约为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高校老师要求学生配制0.1 mol/L的KMnO4溶液100mL。完成下列实验。
【实验一】研究温度对反应速率的影响,学生取两只试管,均加入4mL 0.1 mol/L的KMnO4酸性溶液和10mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。写出此反应的离子方程式: 。
【实验二】测定某乙二酸溶液的浓度,具体操作为:
(1)滴定:准确量取25.00 mL乙二酸溶液于锥形瓶中,加少量酸酸化,将KMnO4溶液装入________(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。
请解释原因: 。待到 ,证明达到滴定终点。
(2)计算:再重复上述操作2次,记录实验数据如下。
序号 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.00 | 22.10 |
则此乙二酸溶液的浓度为 。
(3) 误差分析:下列操作会导致乙二酸溶液浓度偏高的是 。
A. 配制KMnO4溶液定容时,仰视观察刻度线
B.未用待测液乙二酸润洗滴定管
C.滴定前锥形瓶有少量水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.滴定时振荡锥形瓶有溶液飞溅出去
F.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com