
【题目】FeCl3蚀刻液由FeCl3和盐酸等组成,可用于蚀刻铜及铜合金等。
(1)加入盐酸可抑制Fe3+及生成的Cu2+的水解, Fe3+水解的离子方程式为____。
(2)FeCl3溶液蚀刻铜的化学方程式为____。
(3)测定某废蚀刻液中Cu2+含量的实验步骤如下:量取25.00mL废蚀刻液,加入足量的NH4HF2(掩蔽Fe3+,消除干扰),加入稍过量KI溶液(2Cu2++4I-=2CuI↓+ I2),在暗处静置5min,然后用0.02000mol·L-1Na2S2O3标准溶液滴定(I2+2S2O![]() =2I-+S4O
=2I-+S4O![]() ),接近终点时,加入淀粉和10mL10%NH4SCN溶液(CuI可吸附少量I2, CuSCN不吸附I2),继续滴定至终点,消耗Na2S2O3溶液20.00mL。
),接近终点时,加入淀粉和10mL10%NH4SCN溶液(CuI可吸附少量I2, CuSCN不吸附I2),继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①不加NH4HF2会导致测得的铜的含量____(填:“偏高”“偏低”或“不变”)。
②通过计算确定该废蚀刻液中铜的含量(单位g·L-1,写出计算过程)____。
【答案】 Fe3++3H2O ![]() Fe(OH)3+3H+ 2FeCl3 + Cu = 2FeCl2 + CuCl2 偏高 1.024g·L-1
Fe(OH)3+3H+ 2FeCl3 + Cu = 2FeCl2 + CuCl2 偏高 1.024g·L-1
【解析】(1)FeCl3为强酸弱碱盐,Fe3+离子水解使溶液呈酸性,水解方程式为Fe3++3H2O ![]() Fe(OH)3+3H+;(2)FeCl3溶液蚀刻铜生成氯化铜和氯化亚铁,反应的化学方程式为2FeCl3 + Cu = 2FeCl2 + CuCl2;(3)①加入足量的NH4HF2掩蔽Fe3+,消除干扰,若不加,则Fe3+会氧化部分I-,使滴定消耗的Na2S2O3标准溶液偏多,导致测得的铜的含量偏高;②根据反应2Cu2++4I-=2CuI↓+ I2、I2+2S2
Fe(OH)3+3H+;(2)FeCl3溶液蚀刻铜生成氯化铜和氯化亚铁,反应的化学方程式为2FeCl3 + Cu = 2FeCl2 + CuCl2;(3)①加入足量的NH4HF2掩蔽Fe3+,消除干扰,若不加,则Fe3+会氧化部分I-,使滴定消耗的Na2S2O3标准溶液偏多,导致测得的铜的含量偏高;②根据反应2Cu2++4I-=2CuI↓+ I2、I2+2S2![]() =2I-+S4
=2I-+S4![]() ,可得2Cu2+~~~~~ I2~~~~~ 2S2
,可得2Cu2+~~~~~ I2~~~~~ 2S2![]() ,故有
,故有![]() =1.024g·L-1。
=1.024g·L-1。


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:
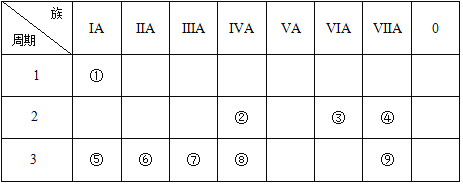
(1)表中用于半导体材料的元素在周期表中的位置__________。
(2)③、④、⑧的原子半径最小是__________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答)。
(5)②和③按原子数1:2形成的化合物的电子式为____,该晶体气化的过程中克服的微粒间作用力为______。
(6)③和⑧形成的化合物属于__________(填“离子化合物”或“共价化合物”),该晶体属于__________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的离子方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列变化中:①碘升华 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水 ⑤过氧化钠溶于水 ⑥氯化铵受热分解 ⑦氧气溶于水
其中:(填序号)未发生化学键破坏的是_______;仅发生离子键破坏的是______;仅发生共价键破坏的是_______;既发生离子键破坏,又发生共价键破坏的是___________。
(2)将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(Lmin)
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(Lmin)
①此时,A的浓度为__________________;
②反应开始前放入容器中B的物质的量为___________;
③B的化学反应速率为_________________________;
④x值为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分。
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):属于电解质的是______,属于非电解质_______。
(2)过量②的水溶液与⑦反应的离子方程式______________________。
(3)某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①请用单线桥标出电子转移的情况____________;
②浓H2SO4表现出来的性质是:_______;当电子转移0.1mol时,消耗氧化剂的物质的量为_______。
(4)如图表示某同学配制480mL 0.5mol/L 的NaOH溶液的部分操作示意图,其中有错误的是_______,这样操作所配制的溶液比要求的浓度要_________ (填“偏高”、“偏低”、“不影响”)。配制应称取NaOH________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸乙烯酯广泛用作电池电解质、酯类合成的中间体等。一种由CH2=CH2、CO2及O2为原料,在铁、铜及碘化物催化下的制备碳酸乙烯酯的反应如下:

(1)Fe2+基态核外电子排布式为____。
(2)写出一种与CO2互为等电子体的阴离子:____。
(3)碳酸乙烯酯中碳原子杂化轨道类型为____;1mol碳酸乙烯酯分子中含![]() 键数目为____。
键数目为____。
(4)FeO晶胞结构如图-1所示,晶体中与每个Fe2+紧邻的Fe2+有____个;一种由Sn、Cu、Fe及S组成的化合物的晶胞结构如图-2所示。该化合物的化学式为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,其对应的化学式正确的是(图中:O-X,●-Y,⊕-Z。C选项中Y原子在面上。)( )
A. X2Y B. XY3
B. XY3 C. XY3Z
C. XY3Z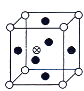 D. XYZ
D. XYZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基丙烯酸酯在碱性条件下能快速聚合为 从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子质量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A 的化学名称为__________________,。
(2)B的结构简式为____________________。其核磁共振氢谱显示为______组峰,峰面积比为_______。
(3)由C生成D的反应类型为_____________。
(4)由D生成E的化学方程式为__________________________________________________________。
(5)G中的官能团有__________、__________、__________。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有___________种。(不含立体结构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com