
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中的化学反应方程式是________________(锰被还原为Mn2+)。
②C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有__________________(写离子方程式)。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否为K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由____________________________________产生(用离子方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。
②根据K2FeO4的制备实验得出:氧化性Cl2________FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。
【答案】2KMnO4+16HCl =2MnCl2+2KCl +5Cl2↑+8H2OCl2+2OH =Cl + ClO + H2OFe3+4FeO42+20H+ = 4Fe3++3O2↑+10H2O排除ClO的干扰,同时保持K2FeO4稳定存在>溶液的酸碱性不同
【解析】
(1)装置A中KMnO4与浓盐酸反应制备Cl2;由于Cl2中混有HCl(g)和H2O(g),HCl(g)会消耗Fe(OH)3和KOH,装置B中应盛放饱和食盐水除去Cl2中混有的HCl(g);C装置中Cl2与KOH、Fe(OH)3反应制备K2FeO4,在此装置中Cl2还可以直接与KOH反应生成KCl、KClO和H2O;D装置中NaOH溶液用于吸收多余Cl2,防止污染大气。
(2)①根据上述制备反应,C的紫色溶液中含有K2FeO4、KCl,还可能含有KClO等。KSCN溶液用于检验Fe3+。根据资料“K2FeO4微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定”分析作答。
②根据同一反应中,氧化性:氧化剂![]() 氧化产物。对比两个反应的异同,制备反应在碱性条件下,方案II在酸性条件下,说明酸碱性的不同影响氧化性的强弱。
氧化产物。对比两个反应的异同,制备反应在碱性条件下,方案II在酸性条件下,说明酸碱性的不同影响氧化性的强弱。
(1)①根据题意,KMnO4与浓盐酸反应生成KCl、MnCl2、Cl2和H2O,反应中Mn元素的化合价由+7价降至+2价,Cl元素的化合价由-1价升至0价,根据电子守恒和原子守恒配平,A中反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
② C中Cl2与KOH、Fe(OH)3反应制备K2FeO4,在此装置中Cl2还可以直接与KOH反应生成KCl、KClO和H2O,反应的化学方程式为Cl2+2KOH=KCl+KClO+H2O,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
(2)①根据上述制备反应,C的紫色溶液中含有K2FeO4、KCl,还可能含有KClO等。
I.溶液a中滴加KSCN溶液至过量,溶液呈红色,说明溶液a中含有Fe3+。Fe3+的产生不能判断FeO42-与Cl-一定发生了反应,根据资料“K2FeO4在酸性或中性溶液中快速产生O2”,自身被还原成Fe3+,根据得失电子守恒、原子守恒和电荷守恒,可能的反应为4FeO42-+20H+=3O2↑+4Fe3++10H2O。
II.C中溶液加入稀H2SO4产生Cl2还可能发生的离子反应为:ClO-+Cl-+2H+=Cl2↑+H2O,即KClO的存在干扰判断;根据资料“K2FeO4微溶于KOH溶液,在碱性溶液中较稳定”,用KOH溶液洗涤的目的是除去KClO、排除ClO-的干扰,同时保持K2FeO4稳定存在。
②制备K2FeO4的原理为3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,在该反应中Cl元素的化合价由0价降至-1价,Cl2是氧化剂,Fe元素的化合价由+3价升至+6价,Fe(OH)3是还原剂,K2FeO4为氧化产物,根据同一反应中,氧化性:氧化剂>氧化产物,得出氧化性Cl2>FeO42-;根据方案II,方案II的反应为2FeO42-+6Cl-+16H+=2Fe3++3Cl2↑+8H2O,由方案II得出氧化性FeO42->Cl2,实验表明,Cl2和FeO42-氧化性强弱关系相反;对比两个反应的条件,制备K2FeO4在碱性条件下,方案II在酸性条件下;说明溶液的酸碱性的不同影响物质氧化性的强弱。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)下列变化中:①碘升华 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水 ⑤过氧化钠溶于水 ⑥氯化铵受热分解 ⑦氧气溶于水
其中:(填序号)未发生化学键破坏的是_______;仅发生离子键破坏的是______;仅发生共价键破坏的是_______;既发生离子键破坏,又发生共价键破坏的是___________。
(2)将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(Lmin)
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(Lmin)
①此时,A的浓度为__________________;
②反应开始前放入容器中B的物质的量为___________;
③B的化学反应速率为_________________________;
④x值为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸乙烯酯广泛用作电池电解质、酯类合成的中间体等。一种由CH2=CH2、CO2及O2为原料,在铁、铜及碘化物催化下的制备碳酸乙烯酯的反应如下:

(1)Fe2+基态核外电子排布式为____。
(2)写出一种与CO2互为等电子体的阴离子:____。
(3)碳酸乙烯酯中碳原子杂化轨道类型为____;1mol碳酸乙烯酯分子中含![]() 键数目为____。
键数目为____。
(4)FeO晶胞结构如图-1所示,晶体中与每个Fe2+紧邻的Fe2+有____个;一种由Sn、Cu、Fe及S组成的化合物的晶胞结构如图-2所示。该化合物的化学式为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,其对应的化学式正确的是(图中:O-X,●-Y,⊕-Z。C选项中Y原子在面上。)( )
A. X2Y B. XY3
B. XY3 C. XY3Z
C. XY3Z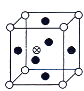 D. XYZ
D. XYZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应。
①用铝与软锰矿(主要成分为MnO2)冶炼锰的原理是________________(用化学方程式来表示)。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是____________________。
③某温度下将氯气通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为1:1,则氯气与KOH反应时,被还原的氯元素和被氧化的氯元素的质量之比为___________。
④12mL 0.lmol/L Na2SO3溶液恰好与4mL 0.lmol/L K2Cr2O7溶液反应,则元素Cr在还原产物中的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列粒子的空间构型
(1)CO2:_______________________
(2)H2S:____________
(3)SO2:___________
(4)NH4+:_________________
(5)CO32-:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基丙烯酸酯在碱性条件下能快速聚合为 从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子质量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A 的化学名称为__________________,。
(2)B的结构简式为____________________。其核磁共振氢谱显示为______组峰,峰面积比为_______。
(3)由C生成D的反应类型为_____________。
(4)由D生成E的化学方程式为__________________________________________________________。
(5)G中的官能团有__________、__________、__________。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有___________种。(不含立体结构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿波罗宇宙飞船以N2H4(联氨)和N2O4为推力源,反应温度达2 700 ℃,反应式为2N2H4+N2O4=3N2+4H2O,关于该反应的说法中正确的是( )
A.属于置换反应B.联氨是氧化剂
C.联氨是还原剂D.氮气是氧化产物,不是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com