解答:
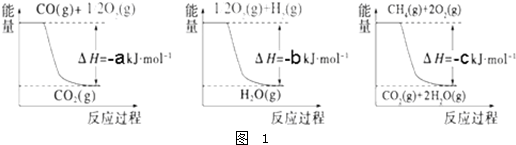
解:Ⅰ.图1、图2、图3写出热化学方程式分别为:
①CO(g)+
O
2(g)═CO
2(g)△H=-akJ?mol
-1 ②H
2(g)+
O
2(g)═H
2O(g)△H=-bkJ?mol
-1③CH
4(g)+2O
2(g)═CO
2(g)+2H
2O(g)△H=-ckJ?mol
-1由③-(①+②×3)得:CH
4(g)+H
2O(g)═CO(g)+3H
2(g)△H=(a+3b-c)kJ?mol
-1,
故答案为:(a+3b-c)kJ?mol
-1;
Ⅱ.(1)a.容器内N
2、H
2、NH
3的浓度之比为1:3:2,不能说明达到判断状态,取决于起始配料比和转化程度,故a错误;
b.当3v(N
2)
正=v(H
2)
逆时,才说明达到平衡状态,故b错误;
c.容器内压强保持不变,可说明达到平衡状态,故c正确;
d.恒容时体积不变,质量不变,则混合气体的密度保持不变,不能达到平衡状态,故d错误.
故答案为:c;
(2)若为恒压容器,甲乙容器中达到平衡所用时间相同,为5min,但是容器恒容,甲容器比乙容器中反应物的浓度小,反应速率比乙中小,故达到平衡所需要的时间更长,即t>5min,故答案为:>;
(3)容器乙中,反应前氮气的浓度为:
=4mol/L,氮气的平均反应速率为:v(N
2)=
=0.2mol?L
-1?min
-1,故答案为:0.2 mol?L
-1?min
-1;
(4)恒温、恒容条件下:
a.假设乙容器的容积为2L,则达到平衡时甲乙为等效平衡,各组分的含量、浓度相等,此时氮气的浓度为c
1,然后将容器的容积缩小到2L,若平衡不移动,2c
1=3mol/L,由于压强增大,平衡向着正向移动,所以2c
1>3mol/L,故a错误;
b.乙中加入了4mol氮气、6mol氢气,而甲中为3mol H
2、2mol N
2,故乙对甲来说相当于加压,平衡右移,氮气的体积分数减小,所以ω
2<ω
1,故b错误;
c.反应前后都是气体,容器的容积都是2L,乙中混合气体的质量为甲的2倍,根据ρ=
,可知:2ρ
1=ρ
2,故c正确;
故选c;
(5)乙容器中,反应前氢气浓度为:c(H
2)=
=4mol/L,氮气的浓度为:
=4mol/L,达到平衡时氮气的浓度变化为:(4-3)=1mol/L,
由三段式可知:3H
2 (g)+N
2(g)?2NH
3(g)
反应前(mol/L):6 4 0
浓度变化(mol/L):3 1 2
反应后:(mol/L):3 3 2
在该温度下乙容器中反应的平衡常数K=
=
,
故答案为:
;Ⅰ.△H=+(a+3b-c) (2分)
(6)NH
4+(aq)+H
2O(l)?NH
3?H
2O(aq)+H
+(aq)平衡常数的表达式为:K=
=
| c(NH3?H2O)×C(H+)×c(OH-) |
| c(N)×c(OH-) |
=
=5.55×10
-10mol?L
-1,所以Kb=1.80×10
-5mol?L
-1,因为Ka
1=5.9×10
-2>Kb,所以草酸氢铵的水溶液中,呈酸性,所以离子浓度的大小顺序为:C(NH
4+)>C(HC
2O
4-)>C(H
+)>C(C
2O
42-)>C(OH
-),故答案为:C(NH
4+)>C(HC
2O
4-)>C(H
+)>C(C
2O
42-)>C(OH
-);
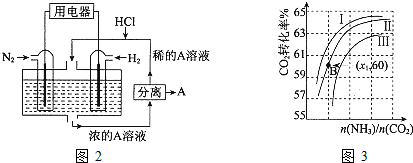
Ⅲ.(1)电池正极发生还原反应,氮气得电子发生还原反应,N
2+8H
++6e
-=2NH
4+,A是铵根离子与氯离子结合形成氯化铵,故答案为:N
2+8H
++6e
-=2NH
4+;氯化铵;
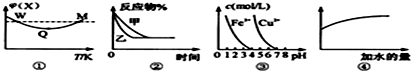
(2)氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为Ⅲ,故答案为:Ⅲ;
由题意可知:2NH
3(g)+CO
2(g)?CO(NH
2)
2+H
2O(g)
起始量 x
1 1
变化量 2a a
即:
=,
=40%,
=60%,则x
1=3,
故答案为:3.