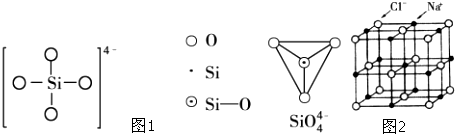
氨的合成是最重要的化工生产之一.
Ⅰ.工业上合成氨用的H
2有多种制取的方法:
①用焦炭跟水反应:C(s)+H
2O(g)
CO(g)+H
2(g);
②用天然气跟水蒸气反应:CH
4(g)+H
2O(g)
CO(g)+3H
2(g)
已知有关反应的能量变化如图1,且方法②的反应只能在高温下发生,则方法②中反应的△H=
kJ/moL.
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H
2(g)+N
2(g)
2NH
3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3mol H2、2mol N2 |
6mol H2、4mol N2 |
2mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol?L-1) |
c1 |
3 |
|
| N2的体积分数 |
ω1 |
ω2 |
ω3 |
| 混合气体密度(g?L-1) |
ρ1 |
ρ2 |
|
(1)下列能说明该反应已达到平衡状态的是
a.容器内N
2、H
2、NH
3的浓度之比为1:3:2 b.v(N
2)
正=3v(H
2)
逆c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t
5min(填>、<或=)
(3)乙中从反应开始到平衡时N
2的平均反应速率
(注明单位).
(4)分析上表数据,下列关系正确的是
.
a.2c
1=3mol/L b.ω
1=ω
2 c. 2ρ
1=ρ
2(5)该温度下,容器乙中,该反应的平衡常数K=
(用分数表示)(mol/L)
-2.
(6)常温下NH
4+(aq)+H
2O(l)?NH
3?H
2O(aq)+H
+(aq)的化学平衡常数为5.55×10
-10mol?L
-1,则NH
3?H
2O的电离平衡常数K=
(保留三位有效数字).已知草酸的电离常数为:Ka
1=5.9×10
-2 Ka
2=6.4×10
-5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:
.
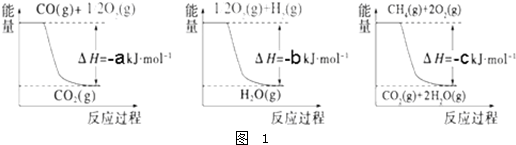
Ⅲ.(1)有人设想以N
2和H
2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示.电池正极的电极反应式是
,A是
.
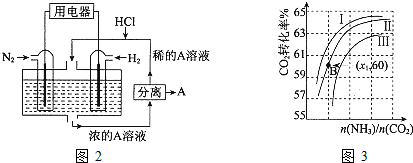
(2)用氨合成尿素的反应为2NH
3(g)+CO
2(g)?CO(NH
2)
2(s)+H
2O(g).工业生产时,原料气带有水蒸气.图3表示CO
2的转化率与氨碳比
、水碳比
的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是
.
②测得B点氨的转化率为40%,则x
1
.



 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案

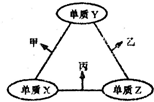 x、y、z三种短周期元素的原子半径依次变小,原子序数之和为16;这三种元素形成的常见单质分别为X、Y、Z,它们在适当条件下可发生如图所示转化关系;其中乙和丙均为l0电子气体分子,且二者相遇生成弱碱.下列说法正确的是( )
x、y、z三种短周期元素的原子半径依次变小,原子序数之和为16;这三种元素形成的常见单质分别为X、Y、Z,它们在适当条件下可发生如图所示转化关系;其中乙和丙均为l0电子气体分子,且二者相遇生成弱碱.下列说法正确的是( )