
| A、原子半径的大小顺序:rX>rY>rW>rQ |
| B、X、Y的最高价氧化物的水化物之间不能发生反应 |
| C、元素Q和Z能形成QZ2型的共价化合物 |
| D、Z元素的氢化物稳定性大于W元素的氢化物稳定性 |


科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| B、Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| C、向Ca(ClO)2溶液中通入过量的 SO2:C1O-+SO2+H2O═HClO+HSO3- |
| D、FeSO4酸性溶液中加H2O2:2Fe2++H2O2═2Fe3++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、5mol Fe和4mol Cl2反应:5Cl2+4Fe
| ||||
| B、2mol KMnO4和3mol H2O2在酸性条件下反应:2MnO4-+3H2O2+6H+═Mn2++4O2↑+6H2O | ||||
| C、在电解液为氢氧化钾的甲醇燃料电池内电路中,阳极的电极反应式为:CH3OH-6e-+8OH-═CO32-+6H2O | ||||
| D、向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| A、原子半径:rW>rZ>rY |
| B、Y形成的离子与W形成的离子的电子数不可能相同 |
| C、化合物X2Y、ZY、WY3中化学键的类型相同 |
| D、由X、Y、Z、W组成的化合物的水溶液可能显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,SO2、NO2、Cl2均为有刺激性气味、有毒的气体 |
| B、Na2CO3粉末遇水生成含有结晶水的碳酸钠晶体,该晶体一定是Na2CO3?10H2O |
| C、人工合成的硅橡胶是目前最好的、既耐高温又耐低温的橡胶 |
| D、合金的硬度可以大于它的纯金属成分,合金的熔点也可以低于它的成分金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B、简单离子的半径:X>Z>M |
| C、由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D、Z单质能从M与R元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水电离出的c(H+)?c(OH-)=10-22的溶液:K+、Na+、SO42-、S2O32- |
| B、澄清透明溶液:Mg2+、Cu2+、Cl-、SO42- |
| C、使酚酞变红色的溶液:NH4+、K+、AlO2-、NO3- |
| D、含0.1mol?L-1 KI的溶液:Fe3+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
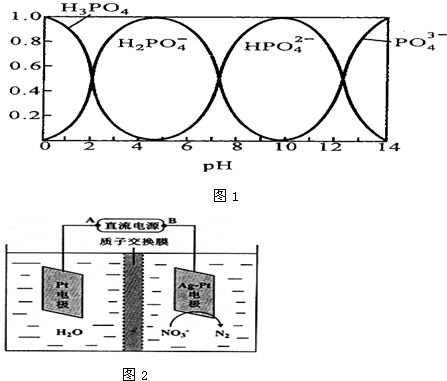
| c(Na+) |
| c(PO43-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com