
【题目】根据水溶液中离子平衡原理回答下列问题:
I.明矾的化学式为____,明矾可用作净水剂,用离子方程式表示明矾的净水原理____
II.常温下有浓度均为0.01mol/L的下列溶液①HNO3 ②H2S ③ NaOH ④NH3·H2O ⑤NH4Cl ⑥NH4HSO4 ⑦ NaCl。回答下列问题:
(1)①②③⑤五中溶液中由水电离出的H+的浓度由大到小的顺序为______(用序号表示,下同)
(2)④⑤⑥三种溶液中NH4+浓度由大到小的顺序为__________________;
(3)①③④⑤⑥⑦六种溶液pH由大到小的顺序为_________________;
(4)等体积的③④分别与同浓度的盐酸反应至均呈中性,消耗盐酸的体积③_____④(填“大于”、“小于”、或“等于”)
(5)10mL ③与20mL⑤混合后,溶液呈_____性(填“酸”、“碱”或“中”),混合溶液中离子浓度由大到小的顺序为______。
【答案】KAl(SO4)212H2O Al3++3H2O![]() Al(OH)3(胶体)+3H+ ⑤>②>①=③ ⑥>⑤>④ ③>④>⑦>⑤>①>⑥ 大于 碱 c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
Al(OH)3(胶体)+3H+ ⑤>②>①=③ ⑥>⑤>④ ③>④>⑦>⑤>①>⑥ 大于 碱 c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
【解析】
I.明矾是十二水合硫酸铝钾,由于硫酸铝钾是强酸弱碱盐,在溶液中Al3+发生水解反应产生氢氧化铝胶体,用盐的水解规律分析判断;
II.(1)根据酸、碱对水的电离平衡起抑制作用,强酸弱碱盐水解促进水的电离;等浓度的H+、OH-对水的电离抑制程度相同分析判断;
(2)盐是强电解质,盐电离产生的离子浓度远大于弱电解质电离产生的离子浓度。NH4+在溶液中存在水解平衡,根据平衡移动原理,分析三种溶液中铵根离子浓度大小;
(3)溶液的酸性越强,pH越小,溶液的碱性越强,pH越大,结合pH=-lg c(H+)分析;
(4)结合生成盐是否水解判断消耗盐酸的体积;
(5)③是NaOH ⑤NH4Cl ,将二者按10mL :20mL混合后发生反应,得到等物质的量浓度的NH3·H2O和NH4Cl、NaCl的的混合液,结合盐的水解及弱电解质电离程度分析比较溶液的酸碱性及离子浓度大小。
I.明矾是十二水合硫酸铝钾,其化学式为KAl(SO4)212H2O;由于硫酸铝钾是强酸弱碱盐,在溶液中Al3+会发生水解反应,产生氢氧化铝胶体,水解的离子方程式为:Al3++3H2O![]() Al(OH)3(胶体)+3H+;胶体表面积大,吸附力强,可吸附水中悬浮的固体,使之形成沉淀,从而具有净水作用;
Al(OH)3(胶体)+3H+;胶体表面积大,吸附力强,可吸附水中悬浮的固体,使之形成沉淀,从而具有净水作用;
II.(1)水存在电离平衡:H2O![]() H++OH-,外加酸或碱,会对水的电离平衡起抑制作用,0.01mol/L的①HNO3是一元强酸,电离产生的c(H+)=0.01mol/L;②H2S是二元弱酸,电离产生的c(H+)<0.01mol/L;③NaOH是一元强碱,电离产生的c(OH-)=0.01mol/L;根据水的电离平衡可知,这三种溶液对水的电离平衡起抑制作用,使水电离程度减小,离子浓度越大,抑制作用就越强,水电离产生的氢离子浓度就越小;而⑤NH4Cl是强酸弱碱盐,电离产生的NH4+发生水解:NH4++H2O
H++OH-,外加酸或碱,会对水的电离平衡起抑制作用,0.01mol/L的①HNO3是一元强酸,电离产生的c(H+)=0.01mol/L;②H2S是二元弱酸,电离产生的c(H+)<0.01mol/L;③NaOH是一元强碱,电离产生的c(OH-)=0.01mol/L;根据水的电离平衡可知,这三种溶液对水的电离平衡起抑制作用,使水电离程度减小,离子浓度越大,抑制作用就越强,水电离产生的氢离子浓度就越小;而⑤NH4Cl是强酸弱碱盐,电离产生的NH4+发生水解:NH4++H2O![]() NH3·H2O+H+,水解消耗水电离产生的OH-,促进水的电离平衡正向移动, 水电离产生的氢离子浓度增大,所以这几种溶液中由水电离出的H+的浓度由大到小的顺序为⑤>②>①=③;
NH3·H2O+H+,水解消耗水电离产生的OH-,促进水的电离平衡正向移动, 水电离产生的氢离子浓度增大,所以这几种溶液中由水电离出的H+的浓度由大到小的顺序为⑤>②>①=③;
(2)④NH3·H2O是弱电解质,在溶液中存在电离平衡:NH3·H2O ![]() NH4++ OH-,电离产生的NH4+离子浓度远小于电解质的浓度;⑤NH4Cl ⑥NH4HSO4都是盐,电离产生的NH4+在溶液中存在水解平衡,NH4++H2O
NH4++ OH-,电离产生的NH4+离子浓度远小于电解质的浓度;⑤NH4Cl ⑥NH4HSO4都是盐,电离产生的NH4+在溶液中存在水解平衡,NH4++H2O![]() NH3·H2O+H+,由于NH4HSO4还会电离产生H+,对铵根的水解起抑制作用,使铵根离子水解程度减小,所以NH4+的浓度⑥>⑤>④;
NH3·H2O+H+,由于NH4HSO4还会电离产生H+,对铵根的水解起抑制作用,使铵根离子水解程度减小,所以NH4+的浓度⑥>⑤>④;
(3)浓度均为0.01mol/L的①HNO3,pH=2;③NaOH是一元强碱,pH=12;④NH3·H2O是一元弱碱,7<pH<12;⑤NH4Cl 是强酸弱碱盐,水解使溶液显酸性,所以pH<7,⑥NH4HSO4电离方程式为NH4HSO4=NH4++H++SO42-,相当于在一元强酸溶液中加入了等浓度的铵根离子,所以酸性比一元强酸强,⑦NaCl是强酸强碱盐,不水解,溶液显中性,所以六种溶液pH由大到小的顺序为③>④>⑦>⑤>①>⑥;
(4)③NaOH ④NH3·H2O的浓度相等,若完全中和,消耗等浓度的盐酸的体积也相等,但NH3·H2O与HCl反应产生的盐NH4Cl水解使溶液显酸性,而NaOH与盐酸反应产生的NaCl不水解,所以要使反应后溶液显中性,则NH
(5)③是NaOH溶液 ⑤NH4Cl溶液 ,将二者按10mL:20mL混合后发生反应NaOH+NH4Cl=NH3·H2O+NaCl,根据方程式可知二者反应时物质的量的比是1:1,由于加入NaOH是10mL,NH4Cl是20mL,二者的浓度相等,所以NH4Cl溶液过量,最终得到等物质的量浓度的NH3·H2O和NH4Cl、NaCl的混合液,由于NH3·H2O的电离作用大于NH4Cl的水解作用,c(OH-)>c(H+),所以溶液显碱性;根据物料守恒可得c(Cl-)=2c(Na+);NH3·H2O电离产生NH4+,溶液中的NH4+由NH4Cl和NH3·H2O电离产生;导致溶液中c(NH4+)> c(Na+),由于盐NaCl是强电解质,盐电离产生的离子浓度c(Na+)大于NH3·H2O电离产生的c(OH-),所以该混合溶液中各种离子浓度大小关系为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)。


科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4A+2B![]() 3C,下列说法中正确的是
3C,下列说法中正确的是
A. 某温度时,化学反应速率无论用A. B. C中任何物质表示,其数值都相同
B. 其他条件不变时,降低温度,化学反应速率减小
C. 其他条件不变时,增大压强,化学反应速率一定加快
D. 若增大或减小A的物质的量,化学反应速率一定会发生明显的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点

(1)在100℃时,Kw表达式为_______,在此温度下,kw为___.
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7则Ba(OH)2与盐酸的体积比为____.
(3)室温时将PH为3的硫酸溶液稀释100倍,稀释后溶液中,C(SO42-)和C(H+)之比约为___.
II.今有①CH3COOH ②HCl ③H2SO4三种溶液.根据要求回答下列问题:
(1)写出①的电离方程式_______.
(2)当它们pH相同时,其物质的量浓度最大的是___(填序号).
(3)当它们的物质的量浓度相同时,其pH最小是___(填序号).
(4)在室温下,将c(H+)均为0.01mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为___(填序号).
(5)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为____.
(6)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为___(填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间有如下转化关系: 下列有关物质的推断不正确的是 ( )
下列有关物质的推断不正确的是 ( )
A. 若甲为AlC13溶液,则丁可能是NaOH溶液 B. 若甲为N2,则丁可能是O2
C. 若甲为Fe,则丁可能是稀硝酸 D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:_________________。
(2)若D物质具有两性,②、③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出反应③的离子方程式:______________。
(3)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,X、Y、Z、W为短周期主族元素,W的原子序数是Z的2倍。下列说法中正确的是
X | Y | Z | ||
W |
A.简单离子半径:Y<Z
B.Y元素的最高价氧化物对应的水化物在一定条件下可以和X单质反应
C.氢化物的沸点:X<Z
D.WZ2具有漂白性,其漂白原理与双氧水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。
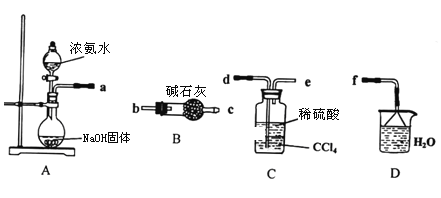
(1)仪器连接的顺序(用接口序号字母表示)是:a_________________
(2)将装置C中两种液体分离开的操作名称是________________。
(3) (NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”。储存应注意_________________。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为___________________________。
(2)由MgCl2溶液蒸发得到MgCl2·6H2O晶体,蒸发的目的是_________。
a.得到热饱和溶液 b.析出晶体
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:__________________________________。
②由MgCl2·6H2O制备无水MgCl2的操作在______________氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是
A. 晶体熔点由低到高:CH4<SiH4<GeH4<SnH4
B. 熔点由高到低:Rb>K>Na
C. 硬度由大到小:金刚石>![]() 碳化硅>晶体硅
碳化硅>晶体硅
D. 晶格能由大到小:NaF> NaCl> NaBr> NaI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com