

| ||


科目:高中化学 来源: 题型:
| A、氯水具有杀菌消毒作用,其中起作用的物质是氯气 |
| B、加碘食盐中所加的“碘”一般是碘化钾 |
| C、区别氯化铁溶液和氢氧化铁胶体可以用丁达尔效应 |
| D、用干燥的有色布条可以检验氯化氢气体中是否混有氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
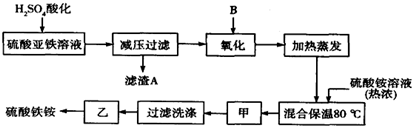
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在同温同压下,相同体积的任何气体含有相同数目的原子 |
| B、氧化还原反应的判断依据是元素化合价是否有变化 |
| C、能导电的物质一定是电解质 |
| D、金属氧化物不一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯中含有少量苯酚,可用NaOH溶液除去 |
| B、NaOH固体中混有NH4HCO3,可直接加热除去NH4HCO3 |
| C、鉴别甲苯与己烯,可滴加酸性KMnO4溶液 |
| D、鉴别某溶液是否含有Fe2+,可先滴加新制氯水,再滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氧气 |
| 点燃 |
| 氧气 |
| 点燃 |
| 稀硫酸 |
| Mg |
| 点燃 |
| NH3、CO2 |
| △ |
| 氯气 |
| 点燃 |
| 氯气 |
| 点燃 |
| A、①④ | B、②③ | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
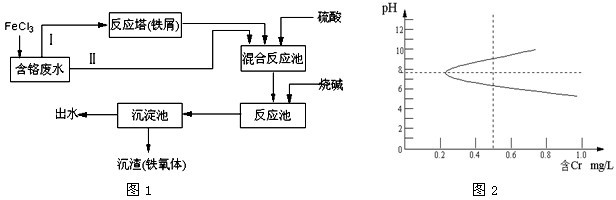
查看答案和解析>>
科目:高中化学 来源: 题型:
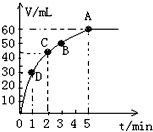 加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.(忽略溶液体积变化)
加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.(忽略溶液体积变化)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com