
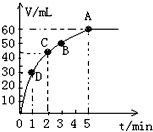
 加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.(忽略溶液体积变化)
加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.(忽略溶液体积变化)
| ||
| 0.06L |
| 22.4L/mol |
| n |
| V |
| △V |
| △t |
| 0.045L |
| 22.4L/mol |
| ||
| 0.06L |
| 22.4L/mol |
| n |
| V |
| 0.0054mol |
| 0.05L |
| △V |
| △t |
| 0.045L |
| 22.4L/mol |
| 0.048g |
| 54.36g |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
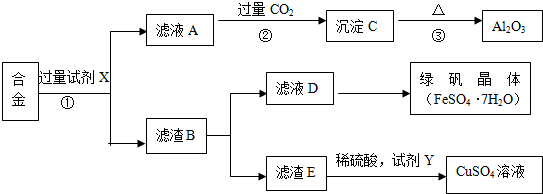
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、①②③⑤⑥ |
| C、①②⑥ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、收集一定量的火山气体通入足量BaCl2溶液中,只能生成BaSO4一种沉淀 |
| B、②③④属于酸性氧化物 |
| C、⑤属于强电解质 |
| D、①②③④属于非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
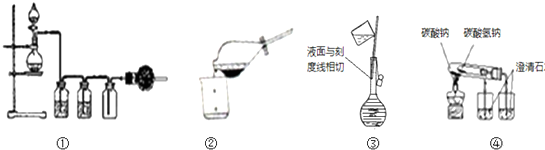
| A、①可用于实验室用MnO2固体与浓盐酸反应,制取并收集干燥、纯净的Cl2 |
| B、②从溴水中萃取溴后的分离操作 |
| C、③配制1mol/LNaCl溶液定容操作 |
| D、用图④操作可比较Na2CO3与NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 开始沉 淀时的 pH值 | 沉淀完 全时的 pH值 |
| Mn(OH)2 | 8.8 | 10.4 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe (OH)3 | 2.7 | 3.7 |
| Zn(OH)2 | 6.4 | 7.8 |
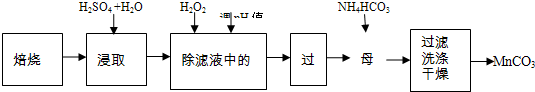
查看答案和解析>>
科目:高中化学 来源: 题型:

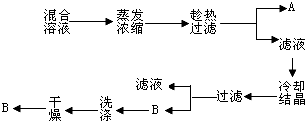
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| ② |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com