
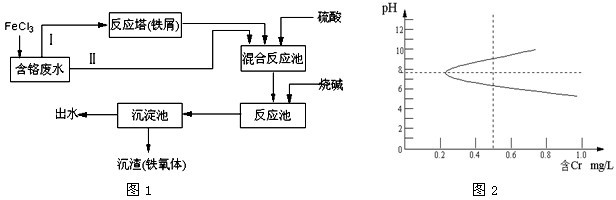
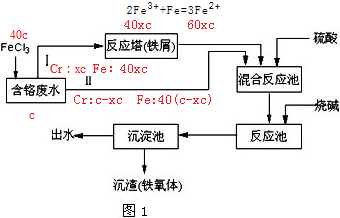
 ;
;| 40(c-xc)+6c |
| 60xc-6c |
| 2 |
| 1 |


科目:高中化学 来源: 题型:
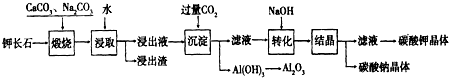
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气、SO2都具有氧化性,故而可用于漂白纸浆等 |
| B、常温下浓硫酸能与铝发生钝化,可在常温下用铝制容器贮运浓硫酸 |
| C、H2CO3是弱酸,所以NaHCO3是弱电解质 |
| D、较强的酸可以制取较弱的酸,次氯酸溶液无法制取盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
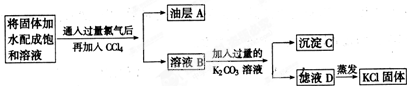
查看答案和解析>>
科目:高中化学 来源: 题型:
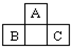 如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:
如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
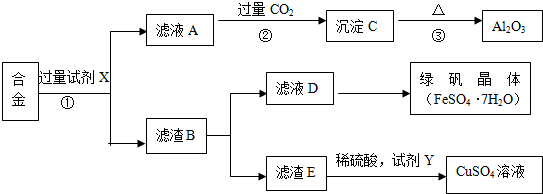
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、①②③⑤⑥ |
| C、①②⑥ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:

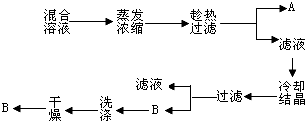
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com