
| 0.01mol×144g/mol |
| 1.76g |


 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后
| ||||||
| B、参加反应的氯气的物质的量等于3a mol | ||||||
| C、改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol | ||||||
| D、改变温度,产物中KClO3的最大理论产量为a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.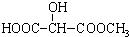 B.
B. C.H3COOC-COOCH3
C.H3COOC-COOCH3 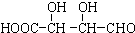 E.
E.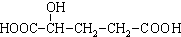
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | D | E |
| 性质 结构 信息 | 单质及其盐的焰色反应为紫色(透过蓝色钻玻璃观察) | 工业上用量最大的金属,在潮湿空气中易锈蚀,生成红棕色粉末状物质. | 单质遇淀粉溶液变蓝色. | 单质为双原子分子,常温下是液态,易溶于有机溶剂. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2Y |
| B、XY2 |
| C、XY3 |
| D、XY |
查看答案和解析>>
科目:高中化学 来源: 题型:
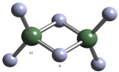 科技日报2007年1月30日讯:美、德科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定不正确的是( )
科技日报2007年1月30日讯:美、德科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定不正确的是( )| A、Al2H6中H为+1价,Al为-3价 |
| B、Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| C、Al2H6分子是非极性分子 |
| D、氢铝化合物可能成为未来的储氢材料和火箭燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当7.8g Na2O2与H2O完全反应时,有0.2mol电子发生了转移 |
| B、将1.5molBr2通入2molFeI2溶液中的离子方程式3Br2+2I-+4Fe2+═2Br-+I2+2Fe3+ |
| C、用浓盐酸酸化KMnO4溶液以增强其氧化性 |
| D、在3NO2+H2O═2HNO3+NO中,氧化剂和还原剂的质量比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com