
【题目】用情性电极电解一定浓度的CuSO4溶液,通电—段时间后,向所得的溶液中加入9.8g Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是( )
A. 电解过程中阴极没有气体生成
B. 电解过程中阳极收集到的气体体枳为1.12 L(标况下)
C. 原CuSO4溶液的浓度为0.1 mol·L-1
D. 电解过程中转移的电子的物质的量为0.4 mol
【答案】D
【解析】Cu(OH)2从组成上可看成CuOH2O,加入9.8g Cu(OH)2即0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1 mol H2SO4,并电解了0.1 mol H2O,由电解的总反应式:
2H2O+2CuSO4![]() 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子
2mol2mol 1mol 4mol
0.1mol0.1mol 0.05mol 0.2mol
2H2O![]() 2H2↑+O2↑ 转移电子
2H2↑+O2↑ 转移电子
2mol 2mol 1mol 4mol
0.1mol 0.1mol 0.05mol 0.2mol
A、根据以上分析,阴极有氢气放出,A错误;B、根据以上分析,阳极收集到的气体体积为(0.05+0.05)×22.4=2.24L,B错误;C、没有体积无法计算,C错误;D、根据以上分析计算,电解过程中共转移电子为0.4 mol,D正确;答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 蛋白质的变性是可逆过程
B. 天然油脂没有恒定的熔点、沸点
C. 氨基乙酸不能溶于强酸溶液中
D. 蔗糖的水解产物不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组分别给出了两个量,不可以求出相应物质的量的是
A | B | C | D |
物质微粒数 | 溶液的质量分数 | 标准状况下气体的摩尔体积 | 物质的质量 |
阿伏加德罗常数 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。下列有关叙述不正确的是( )
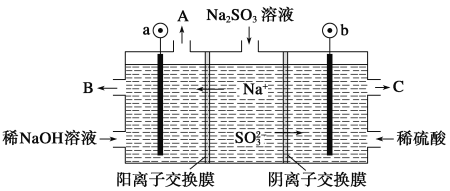
A.图中a极连接电源的负极
B.A口放出的物质是氢气,C口放出的物质是氧气
C.b极电极反应式为:SO32--2e-+H2O===SO42-+2H+
D.电解过程中阴极区碱性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应:K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O中,用氧化还原反应的知识分析:____是氧化剂,_____是还原剂,____是还原产物,____是氧化产物,电子转移总数是___e-,用“双线桥法”表示反应中电子转移的方向和数目:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水资源可以制备氯化铵、纯碱、金属镁等物质,其流程如下:

(1)反应①~⑤中,属于氧化还原反应的是______________(填序号)。
(2)写出反应②的离子方程式__________________________________________________。
(3)X溶液中的主要阳离子是Na+和____________。
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③_____;④加适量盐酸;⑤_____(请补全缺少的实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽,测得放出热量a kJ。又知12.0 g碳完全燃烧,放出热量为 b kJ。则热化学方程式C(s)+![]() O2(g)===CO(g) ΔH=Q 中Q等于( )
O2(g)===CO(g) ΔH=Q 中Q等于( )
A. -(a-b) kJ·mol-1 B. -(a+b) kJ·mol-1
C. -(5a-0.5b) kJ·mol-1 D. -(10a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状态下,两种气态烷烃混合物的密度是1.16 g·L-1,此混合物组成不可能的是( )
A. 甲烷和乙烷 B. 乙烷和丙烷 C. 甲烷和丙烷 D. 甲烷和丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Ba2+ 、Mg2+ 、Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:

(1)沉淀1的化学式为__________,生成该沉淀的离子方程式为_______________。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为_______________。取溶液2反应前,怎样检验SO42-已除去_______________。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为_______________。
(4)如果原溶液中Ba2+ 、Mg2+ 、Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com