
科目:高中化学 来源: 题型:选择题
| A. | 该矿泉水越鲜越好 | |
| B. | 该矿泉水宜存放一段时间再用 | |
| C. | 鲜用和存放一段使用对人体危害是一样的 | |
| D. | 越深层开采矿泉水,污染程度越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸氧腐蚀时正极放出O2 | |
| B. | 析氢腐蚀时正极放出H2 | |
| C. | 析氢腐蚀比吸氧腐蚀普遍 | |
| D. | 析氢腐蚀与吸氧腐蚀的负极反应都是Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
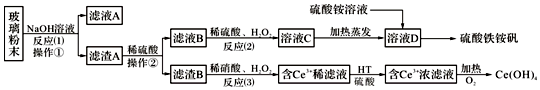
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶作袋装食品的干燥剂没有发生化学变化 | |
| B. | 碳纤维是一种新开发的材料,它属于合成有机高分子化合物 | |
| C. | Al2O3用作耐火材料,Al(OH)3用作阻燃剂 | |
| D. | 小苏打是治疗胃酸过多的一种药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com