
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+2CCl4(g)=TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下 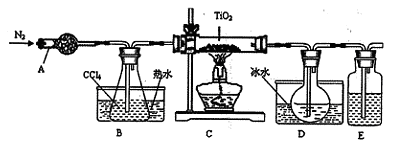
有关性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与 TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |

(1)(球形)干燥管 浓硫酸 检查装置的气密性 ②③① 蒸馏
(2)①铁粉 由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4·7H2O中导致TiO2产率降低。②Fe2+ H2O2+2Fe2++2H+=2Fe3++2H2O Fe2O3
解析
试题分析:(1)仪器A的名称是球形干燥管,仪器B的作用是加热CCl4,使整个装置充满四氯化碳蒸汽。任何有气体参加的反应或制备气体的反应,在反应开始前都要检查装置的气密性。反应结束后为了防止TiCl4潮解,正确的操作顺序是②熄灭酒精灯③冷却至室温 ①停止通氮气 。TiCl4和CCl4的混合物,因为它们是沸点不同的、互溶的液态混合物,所以分离二者的方法是蒸馏。(2)①在钛铁矿FeTO3中含有Fe2O3、SiO2等杂质。在加入H2SO4时钛铁矿及Fe2O3溶解在其中,不能溶解的SiO2通过过滤分离除去。在滤液中含有Fe2 (SO4)3,为了制取纯净的绿矾,要在钛液中加入Fe粉把Fe2 (SO4)3还原为FeSO4。由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4·7H2O中导致TiO2产率降低。②滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+。其中发生氧化还原反应的离子方程式H2O2+2Fe2++2H+=2Fe3++2H2O。在H2TiO3受热分解时,其中的杂质Fe(OH)3也发生了分解反应:2Fe(OH)3 Fe2O3+3H2O 。分解产生的Fe2O3混在TiO2使物质发黄。
Fe2O3+3H2O 。分解产生的Fe2O3混在TiO2使物质发黄。


科目:高中化学 来源: 题型:实验题
氮化铝(AlN)是一种新型无机材料。某氮化铝(AlN)仅含有Al2O3杂质,某学习小组为测定该氮化铝样品中AlN的纯度,查阅资料得知:AlN + NaOH + 3H2O = Na[Al(OH)4] + NH3↑。设计如下2种方案。
方案一:量气法——如图所示。
(1)按图连接好装置,检查装置气密性的方法是 。
(2) 导管a的主要作用是 。
(3)为测定生成气体的体积,量气装置中的X液体可以是: 。(填标号)
| A.CCl4 | B.H2O | C.NH4Cl溶液 | D.植物油 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);竖直冷凝管的主要作用是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物,已知B、C装置中为常见物质的水溶液。
B装置检验的物质是_________,写出C装置中主要的化学方程式:_______________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl2 BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
【设计实验】 某同学设计如图所示装置制备三氯化硼: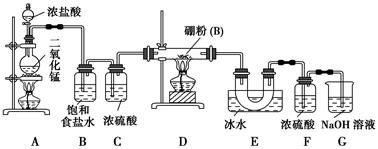
请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:_______________________。
(2)E装置的作用是_______________________________________。
如果拆去B装置,可能的后果是_______________________________________
_________________________。
(3)写出D装置中发生反应的化学方程式:_____________________________
实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:______________________________;
实验室保存三氯化硼的注意事项是__________________________________。
(5)为了顺利完成实验,正确的操作是________(填序号),并解释原因:________。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:
________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
过氧化尿素是一种新型漂白、消毒剂,漂白、消毒效果优于H2O2和过氧乙酸,某工业用过氧化尿素的部分参数列于下表。
| 分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
| CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75—85℃ | 500g·L—1 |
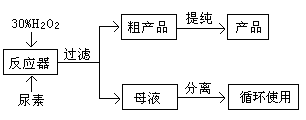

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:
①在酸性条件下,I-能被N 氧化成I
氧化成I ,被H2O2或O2等氧化成I2;
,被H2O2或O2等氧化成I2;
②I 能被HS
能被HS 还原成I2。
还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、I 中的哪一种。
中的哪一种。
限选试剂如下:1.0 mol·L-1 HNO3溶液、1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 NaHSO3溶液、3% H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3: 。
Ⅱ .设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡 | 若溶液显 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: | 若溶液显蓝色,则假设2成立,反应的离子方程式为 ; 否则,假设2不成立,再进行步骤3 |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
(1)ClO2发生器中的反应为:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。实际工业生产中,可用硫磺、浓硫酸代替原料中的SO2,其原因为 (用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的: 。
(3)吸收器中生成NaClO2的离子反应方程式为 ,其中反应温度不能高于5℃的可能原因: 。
(4)某化学兴趣小组用如下图所示装置制备SO2并探究SO2与Na2O2的反应:
①为除去过量的SO2,C中盛放的试剂为 。
②D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为 、Na2O2+SO2= Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某课外活动小组的同学,研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题:
(1)锌与浓硫酸反应制取二氧化硫的化学方程式为______________________________。
(2)这样制取的二氧化硫气体中可能含有的杂质是__________________;原因是________________________________________________________________________________________________________________________________________________。
(3)某同学用下列装置连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是________(用a、b……填写)。
(4)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | | | |
| C | CuO固体 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
Ⅰ.(1)已知某有机物A只含有C、H、O三种元素,通过元素分析知含碳54.55%,含氢9.10%。质谱分析其相对分子质量为88,经红外光谱分析其中只含C-H键和 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
_______________。
(2)写出实验室制备A的化学方程式_________________________________________。
Ⅱ.苯甲酸甲酯( )是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠(
)是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯。已知:
)]、甲醇为原料制备苯甲酸甲酯。已知:
| | 熔点 ℃ | 沸点 ℃ | 水溶性 |
| 甲醇 | —97.8 | 64.7 | 易溶 |
| 苯甲酸(一元弱酸) | 122.4 | 249.3 | 常温:0.17g;100℃:6.8g |
| 苯甲酸甲酯 | —12.3 | 198 | 难溶 |





查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com