
【题目】用稀H2SO4、NaOH和Al为原料制取Al(OH)3, 有下列三种不同的途径:
甲: ![]()
乙: ![]()
丙: 
若制取等量的Al(OH)3则( )
A. 甲、乙消耗的原料同样多 B. 乙消耗的原料最少
C. 丙消耗的原料最少 D. 三者消耗的原料同样多
【答案】C
【解析】设制取2molAl(OH)3,三途径均需要2molAl,其它原料按反应方程式计算:甲:2Al+3H2SO4═Al2(SO4)3+3H2↑、6NaOH+Al2(SO4)3=2Al(OH)3↓+3Na2SO4,生成2molAl(OH)3消耗3molH2SO4和6molNaOH;乙:2Al+2NaOH+2H2O═2NaAlO2+3H2↑、2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4,生成2molAl(OH)3消耗1molH2SO4和2molNaOH;丙:2Al+3H2SO4═Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑、Al2(SO4)3+6NaAlO2+12H2O═8Al(OH)3↓+3Na2SO4,生成8molAl(OH)3需要1molAl2(SO4)3(用3molH2SO4制得)和6molNaAlO2(用6molNaOH制得),生成8molAl(OH)3需要3molH2SO4和6molNaOH,即生成2molAl(OH)3消耗![]() molH2SO4和
molH2SO4和![]() molNaOH;比较得知丙消耗的原料最少;故选C。
molNaOH;比较得知丙消耗的原料最少;故选C。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2 . 图是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是(填“增大”、“减小”、“不变”),反应热△H的变 化是(填“增大”、“减小”、“不变”).请写出反应进程CH3OH(g)和H2O(g)反应的热化学方程式 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以用来断定碳酸氢钠粉末中是否混有碳酸钠的实验方法是( )
A. 加热时有无气体放出
B. 滴加盐酸时有无气泡放出
C. 溶于水后,滴加稀的氯化钙溶液看有无白色沉淀生成
D. 溶于水后,滴加澄清石灰水,看有无白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.常温下水电离出的c(OH﹣)=10﹣13的溶液中:Na+、ClO﹣、F﹣、K+
B.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl﹣、Br﹣
C.含有大量Al3+的溶液:Na+、Cl﹣、S2﹣、OH﹣
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO ![]() 、S2﹣、SO
、S2﹣、SO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:
( i)MnO4﹣+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
( ii)MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入1.80g草酸,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.020molL﹣1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应.试回答下列问题:
①方程式( i)配平后H2C2O4的计量系数为 .
②0.020molL﹣1KMnO4标准溶液应置于(填“甲”或“乙”)滴定管中;滴定终点的颜色变化是 .
③你能否帮助该研究小组求得软锰矿中MnO2的质量分数;若“能”,请给出计算结果;若“否”,试说明原因.“能”的计算结果或“否”的原因说明 .
④若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 .
A.滴定前尖嘴部分有一气泡,滴定终点时消失
B.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
C.滴定前仰视读数,滴定后俯视读数
D.定容时,俯视刻度线
E.锥形瓶水洗之后未用待测液润洗.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH=5的H2SO4溶液稀释1000倍后,溶液中SO42﹣离子浓度与H+离子浓度的比值约为( )
A.1:10
B.1:1
C.1:2
D.1:20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.
(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式为 . 有关反应的化学变化的化学方程式为 .
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液.①A是NaHCO3时,该反应的离子方程式为: .
②A是一种淡黄色固体,且A与B以物质的量之比为2:1相混合时,推知B的化学式为: .
(3)若A是碳化钙(CaC2),A与B的溶液反应时只生成气体C、CaCO3和水;则B的化学式为 . 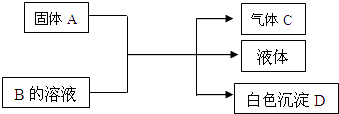
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com