
����Ŀ��ij�������÷�ͭ��������������Ϊԭ�������������������£�

��1���������������������һ����Ҫ�Ļ���ԭ�ϣ��Ʊ���������Ҫͨ���������̣�����NH3��Ϊԭ�ϵĸù��̷�Ӧ��ѧ����ʽΪ____________________����HNO3��������________������������ڹ�ҵ������Ũ��������SO3����ֱ����H2O���յ�ԭ����____________________
��2������ʱϡ�����Cu��Ӧ�����ӷ���ʽΪ______________________________________
��3�����Ƶõĵ����м���Ũ������ɰ�ɫ���ʣ��˹���������Ũ�����_____________�ԡ�
���𰸡�4NH3��5O2 ![]() 4NO��6H2O��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO N2O5 SO3��H2O����ʱ���ų������ȡ�����ˮ��ϡ���������ռ�ʱ�����γ������������ٶȼ�����������SO3������ 3Cu��2NO3-+8H+��3Cu2+��2NO����4H2O ��ˮ
4NO��6H2O��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO N2O5 SO3��H2O����ʱ���ų������ȡ�����ˮ��ϡ���������ռ�ʱ�����γ������������ٶȼ�����������SO3������ 3Cu��2NO3-+8H+��3Cu2+��2NO����4H2O ��ˮ
��������
�ɻ�ѧ�������̿�֪����ͭ���е�����ͭ��ϡ���ᡢϡ���ᷴӦ��������ͭ��NO��ˮ����Ӧ����ʽΪ3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O�������Һ�м�������ͭ������Һ��pH��ʹ������ת��ΪFe��OH��3���������ˣ���������Ҫ�ɷ�ΪFe��OH��3����ҺΪ����ͭ��Һ������ͭ��Һ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ�������
��1����ҵ���ð����Ʊ�����Ĺ���Ϊ�������ڴ��������£����������ȷ�Ӧ��������һ��������ˮ����Ӧ�Ļ�ѧ����ʽΪ4NH3��5O2 ![]() 4NO��6H2O��һ��������������Ӧ���ɶ�����������Ӧ�Ļ�ѧ����ʽΪ2NO+O2=2NO2������������ˮ��Ӧ���������һ����������Ӧ�Ļ�ѧ����ʽΪ3NO2+H2O=2HNO3+NO�����������Ϊ��������������ѧʽΪN2O5����SO3��H2O����ʱ����Ӧ�ų������ȣ���ˮ����SO3ʱ�����γ������������ٶȼ�����������SO3�����գ����Թ�ҵ������Ũ��������SO3����ֱ����H2O���գ��ʴ�Ϊ��4NH3��5O2
4NO��6H2O��һ��������������Ӧ���ɶ�����������Ӧ�Ļ�ѧ����ʽΪ2NO+O2=2NO2������������ˮ��Ӧ���������һ����������Ӧ�Ļ�ѧ����ʽΪ3NO2+H2O=2HNO3+NO�����������Ϊ��������������ѧʽΪN2O5����SO3��H2O����ʱ����Ӧ�ų������ȣ���ˮ����SO3ʱ�����γ������������ٶȼ�����������SO3�����գ����Թ�ҵ������Ũ��������SO3����ֱ����H2O���գ��ʴ�Ϊ��4NH3��5O2 ![]() 4NO��6H2O��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��N2O5��SO3��H2O����ʱ���ų������ȡ�����ˮ��ϡ���������ռ�ʱ�����γ������������ٶȼ�����������SO3�����գ�
4NO��6H2O��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��N2O5��SO3��H2O����ʱ���ų������ȡ�����ˮ��ϡ���������ռ�ʱ�����γ������������ٶȼ�����������SO3�����գ�
��2��ϡ�����Cu��Ӧ��������ͭ��һ��������ˮ����Ӧ�����ӷ���ʽΪ3Cu��2NO3-+8H+��3Cu2+��2NO����4H2O���ʴ�Ϊ��3Cu��2NO3-+8H+��3Cu2+��2NO����4H2O��
��3��Ũ���������ˮ�ԣ��ܹ�ʹ����ʧȥ�ᾧˮ������ˮ����ͭ���ʴ�Ϊ����ˮ�ԡ�


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��ѧ��ӦA2(g)��2B2(g)===2AB2(g)(AB2�ķ��ӽṹΪB��A��B)�������仯��ͼ��ʾ�������й���������ȷ����( )

A. �÷�Ӧ�Ƿ��ȷ�Ӧ
B. �÷�Ӧ�Ħ�H����(E1��E2) kJ�� mol��1
C. �÷�Ӧ�з�Ӧ��ļ����ܺʹ���������ļ����ܺ�
D. ��2 mol A(g)��4 mol B(g)�γ�4 mol A��B������E2 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. 117g������C=C˫�������ʵ���Ϊ4.5mol
B. Ũ�Ⱦ�Ϊ0.1mol/L��CH3COOH��CH3COONa��Һ�������� c(CH3COO��)+ c(CH3COOH)=2c(Na+)
C. 1molCl2��������NaOH��Һ��Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ2 mol
D. Ksp(BaSO4)=1.07��10-10��Ksp(BaCO3)=2.58��10-9�������κ����������ܽ�BaSO4ת��ΪBaCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�������˵����ȷ���ǣ� ��
A.ˮ����� c��H+��=1��10��13 molL��1һ���ʼ���B.pH=7����Һһ��������
C.c��OH����=c��H+������Һһ��������D.����ʹ��̪��Һ������Һһ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥCuCl2��Һ�е�FeCl3,���ڼ��Ƚ���������¼���һ���Լ�,���Լ���( )
A.NaOHB.Na2CO3C.Cu(OH)2D.��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С��ͬѧ��������װ���Ʊ���������̽�����������ʣ�������������ȥ������ش��������⣺
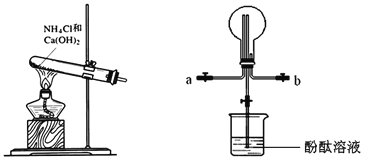
A B
��1��ʵ�����Ʊ������Ļ�ѧ����ʽΪ______�����ﰱ�����õĸ������_____��
��2���ռ�����ʱ������ѡ�����Ľ�����_________���a����b������
��3���١����۲쵽װ��B�е���ƿ�ڲ����˺�ɫ��Ȫ����˵���������е�������_____��
�ڡ���װ��B�е���ƿ�����������壬�ձ���ʢ��Һ�壬��������в������γ���Ȫ����___
A HCl��H2O B H2��H2O C CO2��NaOH
��4�������ڴ������Ҽ���ʱ�ᱻ�������������ǹ�ҵ������ĵ�һ����Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ��2A��g��+B��g��2C��g�������д�ʩ��ʹ��Ӧ���л���Ӱٷ�������ѧ��Ӧ���ʺͻ�ѧƽ�ⳣ�����仯���ǣ� ��
A.����ѹǿB.�����¶�C.ʹ�ô���D.�����O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. ���зǽ���Ԫ�ض��ֲ���p��
B. ����������Ϊ2��Ԫ�ض��ֲ���s��
C. Ԫ�����ڱ��е���B�嵽����B��10�����е�Ԫ�ض��ǽ���Ԫ��
D. ͬһ����Ԫ�ش��ϵ��£������Գ������Ա仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g)+O2(g)2SO3(g)����Ӧ���̵������仯��ͼ��ʾ��
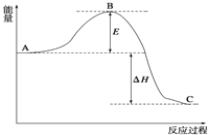
��֪1molSO2(g)����Ϊ1molSO3(g)����H=-99kJ/mol��
��ش��������⣺
(1)E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ�� ______ Ӱ�죿(����������������)���÷�Ӧͨ����V2O5����������V2O5��ʹͼ��B�� ______ (��������������������)��
(2)ͼ����H= ______ kJ/mol��
(3)�����Ӧ������(SO2)Ϊ0.05mol/(Lmin)������(O2)= ______ mol/(Lmin)��
(4)1molSO2(g)����Ϊ1molSO3(g)�ķ�Ӧ����H1 ______ 1molSO3(g)��ԭΪ1molSO2(g)�ķ�Ӧ����H2(������������=��) ��
(5)��֪�������ȼ����Ϊ296kJ/mol��������S(s)����3molSO3(l)����H= _________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com