
【题目】2SO2(g)+O2(g)2SO3(g),反应过程的能量变化如图所示.
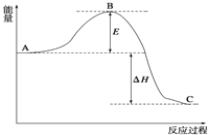
已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJ/mol.
请回答下列问题:
(1)E的大小对该反应的反应热 ______ 影响?(填“有”或“无”).该反应通常用V2O5作催化剂,加V2O5会使图中B点 ______ (填“升高”或“降低”);
(2)图中△H= ______ kJ/mol;
(3)如果反应速率υ(SO2)为0.05mol/(Lmin),则υ(O2)= ______ mol/(Lmin);
(4)1molSO2(g)氧化为1molSO3(g)的反应热△H1 ______ 1molSO3(g)还原为1molSO2(g)的反应热△H2(填“>、<或=”) 。
(5)已知单质硫的燃烧热为296kJ/mol,计算由S(s)生成3molSO3(l)的△H= _________________
【答案】无降低-1980.025<-1185 kJ/mol
【解析】
(1)因图中A、C分别表示反应物总能量、生成物总能量,E为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂,活化能减小,反应反应热不变,故答案为:无;降低;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJmol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198kJmol-1,故答案为:-198;
(3)反应的化学方程式为:2SO2(g)+O2(g)2SO3(g),反应速率之比等于系数之比,v(SO2):v(O2):v(SO3)=2:1:2,反应速率υ(SO2)为0.05 mol/(Lmin),依据比例计算得到v(O2)=0.025mol/(Lmin), 故答案为:0.025;
(4)二氧化硫氧化生成三氧化硫的反应为放热反应,△H<0,其逆过程为吸热反应,△H>0,因此1molSO2(g)氧化为1molSO3(g)的反应热△H1 小于1molSO3(g)还原为1molSO2(g)的反应热△H2,故答案为:<;
(5)单质硫的燃烧热为296kJmol-1,热化学方程式为:①S(s)+O2(g)=SO2(g) △H1=-296 KJmol-1,已知1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1,热化学方程式为②SO2(g)+1/2O2(g)SO3(g) △H2=-99 kJmol-1 ;依据盖斯定律,②+①得到:③S(s)+O2(g)=SO3(g) △H=(△H1+△H2)kJ/mol;计算由S(s)生成3molSO3(g)③×3得到:3 S(s)+9/2O2(g)=3SO3(g) △H=3(△H1+△H2)=-1185 kJmol-1,故答案为:-1185 kJmol-1。


科目:高中化学 来源: 题型:
【题目】某化工厂用废铜渣(含少量铁)为原料生产胆矾的流程如下:

(1)本化工厂所需的硝酸是一种重要的化工原料,制备该硝酸主要通过三个过程,则以NH3作为原料的该过程反应化学方程式为____________________。该HNO3的酸酐是________。所需的硫酸在工业上是用浓硫酸吸收SO3,不直接用H2O吸收的原因是____________________
(2)浸出时稀硝酸和Cu反应的离子方程式为______________________________________
(3)将制得的胆矾中加入浓硫酸会变成白色物质,此过程体现了浓硫酸的_____________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 周期表是按原子量逐渐增大的顺序从左到右排列的
B. 最外层电子数相同的元素都是同一族
C. 同族元素的最外层电子数一定相同
D. 同周期主族元素的电子层数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pH=-lgc(H+),pOH=-lgc(OH-)。常温下,向某浓度的盐酸溶液中滴加氨水溶液,所得溶液pOH和pH变化如图所示。下列说法不正确的是
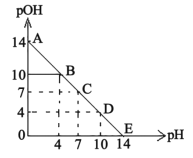
A. 盐酸的初始浓度为0.1molL1
B. B点溶液和D点溶液水电离的氢氧根离子浓度相等
C. C点溶液中c(NH4+)=c(Cl)
D. 升高温度(高于25℃),滴定过程中pOH+pH<14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是
选项 | 化学反应 | 测量依据(单位时间内) |
A | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | 2NO2(红棕色)N2O4(无色) | 颜色深浅 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应2SO2+O2![]() 2SO3,反应达平衡的标志是
2SO3,反应达平衡的标志是
①单位时间内消耗2 mol SO2的同时生成2 mol SO3
②反应混合物中,SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A. ①②B. ①③C. ①D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是( )
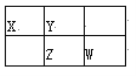
A. Z元素位于周期表的第三周期第VA族
B. X、W元素的最高价氧化物对应水化物的酸性:W强于X
C. Y元素的气态氢化物的热稳定性比Z的高
D. X与W形成共价化合物XW2, X的原子半径比Y小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2SO2(g)+O2 ![]() 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 已知H+(aq)+OH-(aq)=H2O(1),△H=-57.3kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ
D. 已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2 则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①C(s)+O2(g)=CO2(g);ΔH=![]() 393.5kJ/mol
393.5kJ/mol
②2CO(g) +O2(g)=2CO2(g);ΔH=![]() 566kJ/mol
566kJ/mol
③CaCO3(s)=CaO(s)+CO2(g);ΔH=![]() 177.7kJ/mol
177.7kJ/mol
④0.5H2SO4(l) +NaOH(l)=0.5Na2SO4(l)+H2O(l);ΔH=![]() 57.3kJ/mol
57.3kJ/mol
⑤HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l);ΔH=![]() 57.3kJ/mol
57.3kJ/mol
(1)上述热化学方程式中,不正确的有___________________(填序号,以下同);
(2)上述反应中,表示燃烧热的热化学方程式是___________________________________;上述反应中,表示中和热的热化学方程式是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com