
【题目】对于可逆反应:2A(g)+B(g)2C(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强B.升高温度C.使用催化剂D.多充入O2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某固定体积的密闭容器中存在化学平衡:a A (g) ![]() b B (g) + c C (g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中不正确的是
b B (g) + c C (g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中不正确的是
A. 无论a、b、c大小关系如何,平衡一定向正方向移动
B. 若a=b+c时,B的物质的量分数不变
C. 若a>b+c时,A的转化率变大
D. 当反应再次达到平衡时,反应速率与原平衡时的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
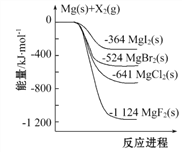
A. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方 程式为:MgBr2(s)+Cl2(g)![]() MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
B. 热稳定性: MgI2 > MgBr2 > MgCl2 > MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂用废铜渣(含少量铁)为原料生产胆矾的流程如下:

(1)本化工厂所需的硝酸是一种重要的化工原料,制备该硝酸主要通过三个过程,则以NH3作为原料的该过程反应化学方程式为____________________。该HNO3的酸酐是________。所需的硫酸在工业上是用浓硫酸吸收SO3,不直接用H2O吸收的原因是____________________
(2)浸出时稀硝酸和Cu反应的离子方程式为______________________________________
(3)将制得的胆矾中加入浓硫酸会变成白色物质,此过程体现了浓硫酸的_____________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线②代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C三点溶液中水的电离程度: A<C<B
D. D点溶液中:c(Cl-)+ 2c(H+)=2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是
A.Fe2O3难溶于水B.Fe3+的水溶液为黄色
C.Fe(OH)2容易被空气氧化D.Fe3+溶液中滴入含SCN-的溶液,立即出现红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图中的信息得出的结论正确的是

A. 2C(s)+O2(g) ═ 2CO(g) ΔH=-110.0 kJ/mol
B. C(s)+O2(g) ═ CO2(g) ΔH=393.5 kJ/mol
C. CO(g)+1/2O2(g) ═ CO2(g) ΔH=-283.0 kJ/mol
D. 36 g碳完全燃烧放出220.0 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 周期表是按原子量逐渐增大的顺序从左到右排列的
B. 最外层电子数相同的元素都是同一族
C. 同族元素的最外层电子数一定相同
D. 同周期主族元素的电子层数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是( )
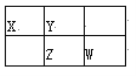
A. Z元素位于周期表的第三周期第VA族
B. X、W元素的最高价氧化物对应水化物的酸性:W强于X
C. Y元素的气态氢化物的热稳定性比Z的高
D. X与W形成共价化合物XW2, X的原子半径比Y小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com