
【题目】近年来雾霾天气经常出现,研究雾霾成因和治理是当前环保的重要话题。汽车尾气和燃煤是造成空气污染的原因之一。因此研究氮氧化物的反应机理,对消除和防治环境污染有重要意义。
(1)①对于2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=-665kJ/mol的反应分三步完成:
a:2NO(g)=N2O2(g)(快)
b:N2O2(g)+H2(g)=N2O(g)+H2O(g)(慢)
c:N2O(g)+H2(g)=N2(g)+H2O(g)(快)
决定此总反应速率的是第步的反应___(填序号)。
②已知:H2(g)+CO2(g)=H2O(g)+CO(g) △H=+41kJ/mol
汽车尾气的净化原理主要是用催化剂把NO与CO反应转化为两种对大气无污染的气体,试写出该反应的热化学方程式:___。
(2)升高温度能让绝大多数的化学反应加快反应速率,但是研究发现2NO(g)+O2(g)=2NO2(g) △H<0存在一些特殊现象。现有某化学小组通过实验测得不同温度下该反应速率常数k(代表反应速率的一个常数)的数值如表:
T(K) | k | T(K) | k | T(K) | k |
143 | 1.48×105 | 273 | 1.04×104 | 514 | 3.00×103 |
195 | 2.58×104 | 333 | 5.50×103 | 613 | 2.80×103 |
254 | 1.30×104 | 414 | 4.00×103 | 663 | 2.50×103 |
由实验数据测到v正与c(O2)的关系如图1所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___点(填字母),并解析原因:
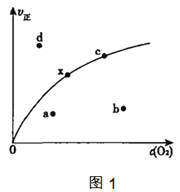
①___
②___
(3)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人得出用活性炭对NOx进行吸收,发生如下反应:
反应a:C(s)+2NO(g)N2(g)+CO2(g) △H=-34.0kJ/mol
反应b:2C(s)+2NO2(g)N2(g)+2CO2(g) △H=-64.2kJ/mol
对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如表:
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①010min内,NO的平均反应速率v(NO)=___,当升高反应温度,该反应的平衡常数K___(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
(4)实验室模拟反应2C(s)+2NO2(g)=N2(g)+2CO2(g) △H=-64.2kJ/mol,在密闭容器中加入一定量的碳和NO2,维持温度是T2℃,如图2为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。
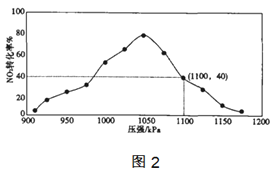
①请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因___;
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数___(用计算表达式表示,不必化简);已知:气体分压(p分)=气体总压(p总)×体积分数。
【答案】b 2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=-747kJ/mol b 升高温度,平衡向吸热方向移动,即是逆向移动,c(O2)增大 升高温度,k减小,正反应速率下降 0.042mol/(Lmin) 减小 bc 1050KPa前反应未达平衡状态,随着压强增大,反应速率加快,NO转化率提高 
【解析】
:(1)①对于2NO(g)+2H2(g)=N2(g)+2H2O(g)△H=-665kJ/mol的反应分三步完成:
a:2NO(g)=N2O2(g)(快)
b:N2O2(g)+H2(g)=N2O(g)+H2O(g)(慢)
c:N2O(g)+H2(g)=N2(g)+H2O(g)(快)
反应机理中最慢的一步反应为决定整个反应的速控步,所以决定此总反应速率的是第b步,
故答案为:b;
②用催化剂把NO与CO反应转化为两种对大气无污染气体,分别为N2和CO2,反应方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g),
已知:①2NO(g)+2H2(g)=N2(g)+2H2O(g)△H1=-665kJ/mol,
②H2(g)+CO2(g)=H2O(g)+CO(g)△H2=+41kJ/mol,
所求反应可由①-②×2得到,根据盖斯定律,该反应的焓变为△H=△H1-2△H2=-747kJ/mol,热化学方程式:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-747kJ/mol,故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-747kJ/mol;
(2)根据,表中数据分析,温度升高,化学反应速率常数不是单一的增大,反应为放热反应,升高温度不利于反应正向进行,当x点升高到某一温度时。反应重新达到平衡,此时反应正向进行程度较大,c(O2)较大,所以相应的点变为b点,故答案为:b;
解析原因为:①升高温度,平衡向吸热方向移动,即是逆向移动,c(O2)增大,②升高温度,k减小,正反应速率下降,故答案为:升高温度,平衡向吸热方向移动,即是逆向移动,c(O2)增大;升高温度,k减小,正反应速率下降;
(3)①C(s)+2NO(g)N2(g)+CO2(g)△H=-34.0kJ/mol,图表数据得到0~10min内,NO的平均反应速率![]() ,反应为放热反应升温平衡逆向进行,平衡常数减小,故答案为:0.042mol/(Lmin);减小;
,反应为放热反应升温平衡逆向进行,平衡常数减小,故答案为:0.042mol/(Lmin);减小;
②30min后,只改变某一条件,反应重新达到平衡,C(s)+2NO(g)N2(g)+CO2(g),依据图表数据分析,平衡状态物质浓度增大,依据平衡常数计算![]() ,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是减小溶液体积后加入一定量一氧化氮;
,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是减小溶液体积后加入一定量一氧化氮;
a.加入一定量的活性炭,碳是固体对平衡无影响,平衡不动,故a错误;
b.通入一定量的NO,新平衡状态下物质平衡浓度增大,故b正确;
c.适当缩小容器的体积,反应前后体积不变,平衡状态物质浓度增大,故c正确;
d.加入合适的催化剂,催化剂只改变化学反应速率,不改变化学平衡,故d错误;
故答案为:bc;
(4)①1050kPa前,反应b中NO2转化率随着压强增大而增大的原因,1050KPa前反应未达平衡状态,随着压强增大,反应速率加快,NO转化率提高,
故答案为:1050KPa前反应未达平衡状态,随着压强增大,反应速率加快,NO转化率提高;
②在1100kPa时二氧化氮转化率40%,结合三行计算列式得到;设通入二氧化氮1mol,则转化的二氧化氮为0.4mol,根据方程式可知生成的N2的物质的量为0.2mol,生成的CO2的物质的量为0.4mol,剩余的二氧化氮为0.6mol,气体总物质的量=1.2mol,压强之比等于物质的量之比,所以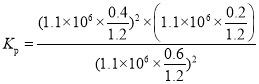 ,故答案为:
,故答案为: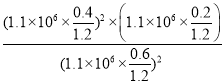 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CF3COOH水溶液中将甲烷直接转化为CH3OH的反应机理如图,下列说法正确的是
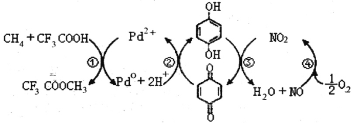
A.所含部分元素第一电离能:C<N<O<F
B.反应③的氧化剂为对苯二酚
C.此法由甲烷制取甲醇的方程式为:2CH4+O2 2CH3OH
2CH3OH
D.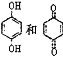 均可以与浓溴水反应,且反应类型相同
均可以与浓溴水反应,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒(V2O5)在冶金、搪瓷、磁性材料等领域具有重要的应用。实验室以含钒废料(含有V2O3、CuO、MnO、SiO2、有机物)为原料制备V2O5的工艺流程如图所示。

已知:Ⅰ.含钒离子在溶液中的主要存在形式与溶液pH的关系如下表所示。
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要存在形式 | VO2+ | VO3- | V2O74- | VO43- |
Ⅱ.25℃时,部分难溶电解质的溶度积常数如下表所示。
难溶电解质 | Cu(OH)2 | Mn(OH)2 |
溶度积常数(Ksp) | 4.8×10-20 | 4×10-14 |
Ⅲ.25℃时,NH4VO3的溶解度为0.4gL-1;70℃时,NH4VO3的溶解度为63gL-1。
请回答下列问题:
(1)“焙烧”的目的是___。
(2)滤渣1的用途为___(任写一种)。
(3)“调pH”的目的除了使Cu2+沉淀完全外,还有___;调节pH为7时,Cu2+是否沉淀完全?___。(写出计算过程,当溶液中离子浓度小于10-5molL-1时,认为该离子沉淀完全)
(4)“沉锰”时,需将温度控制在70℃左右,温度不能过高或过低的原因为___。
(5)“浓缩结晶”后,需对所得NH4VO3进行洗涤、干燥。洗涤剂宜选用___;证明NH4VO3已洗涤干净的实验操作及现象为___。
(6)“煅烧”时,生成无污染性气体,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B. 已知C(s)+O2(g)=CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则2ΔH1<ΔH2
C. 已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ/mol(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
2SO3(g) ΔH=-QkJ/mol(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
D. 已知:C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料。用CO2催化加氢可制取乙烯:CO2(g)+3H2(g)![]()
![]() C2H4(g)+2H2O(g) ΔH<0
C2H4(g)+2H2O(g) ΔH<0
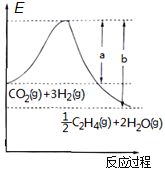
(1)若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=__kJ/mol。(用含a、b的式子表示)
(2)几种化学键的键能如表所示,实验测得上述反应的△H=-76kJ/mol,则表中的x=__。
化学键 | C=O | H—H | C=C | C—H | H—O |
键能/kJ·mol-1 | x | 436 | 612 | 414 | 464 |
(3)向1L恒容密闭容器中通入1molCO2和nmolH2,在一定条件下发生上述反应,测得CO2的转化率α(CO2)与反应温度T、压强P的关系如图所示。
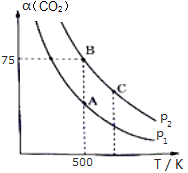
①P1___P2(填“>”、“<”或“=”,下同)。
②平衡常数KB__KC。
③若B点时投料比![]() =3,则平衡常数KB=__(代入数据列出算式即可,不用化简)。
=3,则平衡常数KB=__(代入数据列出算式即可,不用化简)。
④其他条件不变时,能同时满足增大反应速率和提高CO2转化率的措施是___。
A.将产物从体系不断分离出去 B.给体系升温
C.给体系加压 D.增大H2的浓度
(4)①以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图所示。则M极上的电极反应式为___。
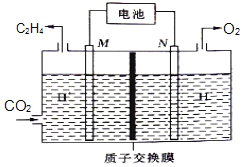
②已知乙烯也能做燃料电池,当消耗标况下2.24L乙烯时,导线中转移电子的数目为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类(填序号)。

(1)芳香烃:_____________ ;
(2)卤代烃:_____________;
(3)醇:_______________ ;
(4)酚:_____________;
(5)醛:_______________ ;
(6)酮:_____________;
(7)羧酸:_____________ ;
(8)酯:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并注明(1)、(2)、(3)的反应类型
(1)由乙烯制备聚乙烯的反应 _______________反应类型:_________________
(2)用甲苯制TNT的反应 __________________反应类型:_________________
(3)溴乙烷与NaOH的乙醇溶液共热 _________________反应类型:_____________
(4)烯烃在一定条件下氧化时,由于C=C键断裂,转化为醛、酮,如:![]() 。若
。若![]() 在上述类似条件下发生反应,请写出反应的方程式 _________________________ 。
在上述类似条件下发生反应,请写出反应的方程式 _________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知

A. X、Y、Z中最简单氢化物稳定性最弱的是Y
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X元素形成的单核阴离子还原性大于Y
D. Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com