
【题目】在CF3COOH水溶液中将甲烷直接转化为CH3OH的反应机理如图,下列说法正确的是
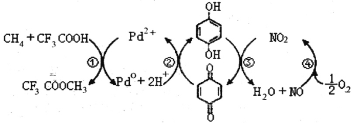
A.所含部分元素第一电离能:C<N<O<F
B.反应③的氧化剂为对苯二酚
C.此法由甲烷制取甲醇的方程式为:2CH4+O2 2CH3OH
2CH3OH
D.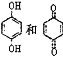 均可以与浓溴水反应,且反应类型相同
均可以与浓溴水反应,且反应类型相同
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):

计算H2(g)+ Br2(g)===2HBr(g)的反应热 ( )
A. +103 kJ·mol-1 B. +679 kJ·mol-1
C. -103 kJ·mol-1 D. +183 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为元素周期表前四周期的元素。其中X原子核外的L层电子数是K层电子数的两倍,Y的内层电子数是最外层电子数的9倍。Z在元素周期表的各元素中电负性最大。W原子的第三电子层处于全充满状态且第四电子层只有2个电子。请回答下列问题:
(1)W元素属于_______区元素。其基态原子的电子排布式为____________
(2)W2+能与氨气分子形成配离子[W(NH3)4]2+。其中配体分子的空间构为________,写出该配离子的结构简式(标明配位键)_________
(3)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,其中X原子的杂化方式为_____;1mol该分子中σ键的数目为__________
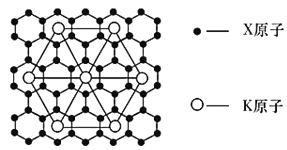
(4)X的某种晶体为层状结构可与熔融金属钾作用。钾原子填充在各层之间形成间隙化合物,其常见结构的平面投影如图所示,则其化学式可表示为____________。
(5)元素Y与元素Z形成的晶体结构如图所示。设晶胞中最近的Y的离子与Z的距离为a pm。该化合物的摩尔质量为b g/ mol,则该晶胞密度的计算式为_________g/cm3
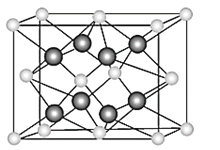
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、X、Y、Z、W为五种短周期元素,且原子序数依次增大,X、Y、Z最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L1;W的质子数是X、Y、Z、M四种元素质子数之和的![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.原子半径:W>Z>Y>X>M
B.常见气态氢化物的稳定性:X<Y<Z
C.1molWM溶于足量水中完全反应,共转移2mol电子
D.由M、X、Y、Z四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO(g) △H=QkJ·mol-1。
N2(g)+CO(g) △H=QkJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下表。
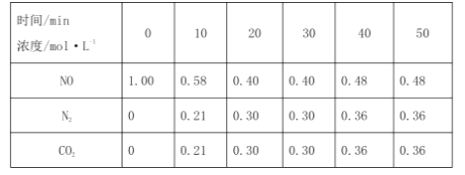
①0~10min内,NO的平均反应速率v(NO)=____,T1℃时,该反应的平衡常数K=____。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是____(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5∶3∶3,则Q____0(填“>”、“=”或“<”)。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。
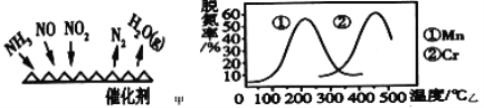
①由图甲可知,SCR技术中的氧化剂为____,已知c(NO2)∶c(NO)=1∶1时脱氮效果最佳,若生成1molN2时反应放出的热量为QkJ。此时对应的脱氮反应的热化学方程式为____。
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应的温度分别为_____、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在现代生产和生活中发挥重要作用。
(1)可以通过热化学循环在较低温度下由硫化氢分解制备氢气。
SO2(g)+I2(s)+2H2O(1)==2HI(aq)+H2SO4(aq) △H1=—151.5kJ·mol-1
2HI(aq)==H2(g)+I2(s) △H2=+110kJ·mol-1
H2S(g)+H2SO4(aq)==S(s)+SO2(g)+2H2O(I) △H3=+65kJ·mol-1
热化学硫碘循环硫化氢分解联产氢气、硫磺的热化学方程式为_________________。
(2)硫酸厂尾气中含有大量SO2,为提高其利用率可用图1所示装置(电极均为惰性电极)将其吸收,而锂—磺酰氯(Li—SO2C12)电池可作为电源电解制备Ni(H2PO2)2(图2)。已知电池反应为:2Li+SO2C12=2LiCl+SO2↑
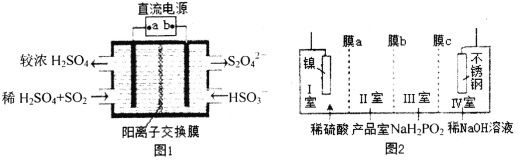
①图1中:a为直流电源的______极(填“负”或“正”),其阴极的电极反应式为_____。
②SO2C12分子中S原子的杂化方式为____________________。
③锂—磺酰氯电池的正极反应式为_______________________。
④图2中膜a为______交换膜(填“阳离子”或“阴离子”下同),膜c为_________交换膜。不锈钢电极的电极反应式为_______________________________。
(3)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g) ![]() 2SO3(g)。
2SO3(g)。
已知:标准平衡常数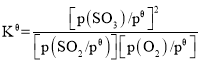 ,其中
,其中![]() 为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为
为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为![]() ,则
,则![]() _______(用含
_______(用含![]() 的最简式表示)。
的最简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.铅蓄电池是典型的可充型电池,电池总反应为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。
2PbSO4+2H2O。
请回答下列问题:
(1)放电时,负极材料是___;电解液中H2SO4的浓度将变___(选“变大”“变小”或“不变”);
(2)充电时,阳极的电极反应式是___。
II.如图是一个化学过程的示意图。

(1)图中甲池是___装置(填“电解池”或“原电池”),其中K+移向___极(选“正”或“负”)
(2)乙池中石墨电极A上发生的电极反应式:___。
(3)若丙内为足量NaCl溶液,当甲池内通入11.2LO2(标准状况下),则丙池中产生的气体的体积为____L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来雾霾天气经常出现,研究雾霾成因和治理是当前环保的重要话题。汽车尾气和燃煤是造成空气污染的原因之一。因此研究氮氧化物的反应机理,对消除和防治环境污染有重要意义。
(1)①对于2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=-665kJ/mol的反应分三步完成:
a:2NO(g)=N2O2(g)(快)
b:N2O2(g)+H2(g)=N2O(g)+H2O(g)(慢)
c:N2O(g)+H2(g)=N2(g)+H2O(g)(快)
决定此总反应速率的是第步的反应___(填序号)。
②已知:H2(g)+CO2(g)=H2O(g)+CO(g) △H=+41kJ/mol
汽车尾气的净化原理主要是用催化剂把NO与CO反应转化为两种对大气无污染的气体,试写出该反应的热化学方程式:___。
(2)升高温度能让绝大多数的化学反应加快反应速率,但是研究发现2NO(g)+O2(g)=2NO2(g) △H<0存在一些特殊现象。现有某化学小组通过实验测得不同温度下该反应速率常数k(代表反应速率的一个常数)的数值如表:
T(K) | k | T(K) | k | T(K) | k |
143 | 1.48×105 | 273 | 1.04×104 | 514 | 3.00×103 |
195 | 2.58×104 | 333 | 5.50×103 | 613 | 2.80×103 |
254 | 1.30×104 | 414 | 4.00×103 | 663 | 2.50×103 |
由实验数据测到v正与c(O2)的关系如图1所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___点(填字母),并解析原因:
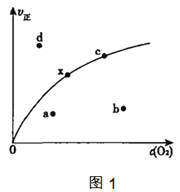
①___
②___
(3)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人得出用活性炭对NOx进行吸收,发生如下反应:
反应a:C(s)+2NO(g)N2(g)+CO2(g) △H=-34.0kJ/mol
反应b:2C(s)+2NO2(g)N2(g)+2CO2(g) △H=-64.2kJ/mol
对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如表:
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①010min内,NO的平均反应速率v(NO)=___,当升高反应温度,该反应的平衡常数K___(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
(4)实验室模拟反应2C(s)+2NO2(g)=N2(g)+2CO2(g) △H=-64.2kJ/mol,在密闭容器中加入一定量的碳和NO2,维持温度是T2℃,如图2为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。
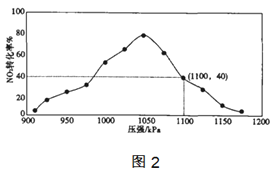
①请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因___;
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数___(用计算表达式表示,不必化简);已知:气体分压(p分)=气体总压(p总)×体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物 M 在有机合成工业和医药方面有重要作用,可按图示合成路线合成 M。
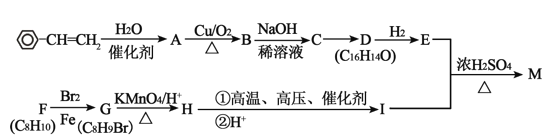
已知:①2CH3CHO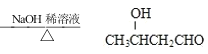
②![]()
③E 的相对分子质量比 D 大 4,F 的核磁共振氢谱中有 5 个吸收峰,G 苯环上的一 氯代物仅有 2 种。
请回答下列问题:
(1)C 的结构简式为_____,D 中官能团的名称是_____。
(2)A→B 的反应类型为_____,C→D 的反应条件为_____。
(3)E 和 I 生成 M 的化学方程式为__________________________。
(4)G→H 与 H→I 的反应不能颠倒,其理由是________________________________。
(5)比 I 的相对分子质量大 14 的同系物 N,可能结构有_____种。
(6)参 照 题 中 信 息 和 合 成 路 线 , 设 计 以 CH2=CHCH3 为 原 料 合 成![]() _______________________
_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com