
����Ŀ��X��Y��Z��WΪԪ�����ڱ�ǰ�����ڵ�Ԫ�ء�����Xԭ�Ӻ����L���������K���������������Y���ڲ��������������������9����Z��Ԫ�����ڱ��ĸ�Ԫ���е縺�����Wԭ�ӵĵ������Ӳ㴦��ȫ����״̬�ҵ��ĵ��Ӳ�ֻ��2�����ӡ���ش��������⣺
(1)WԪ������_______��Ԫ�ء����̬ԭ�ӵĵ����Ų�ʽΪ____________
(2)W2+���백�������γ�������[W(NH3)4]2+������������ӵĿռ乹Ϊ________��д���������ӵĽṹ��ʽ(������λ��)_________
(3)X�����⡢����������Ԫ�ع��ɻ�����XO(NH2)2������Xԭ�ӵ��ӻ���ʽΪ_____��1mol�÷�������������ĿΪ__________
(4)X��ij�־���Ϊ��״�ṹ�������ڽ��������á���ԭ������ڸ���֮���γɼ�϶������䳣���ṹ��ƽ��ͶӰ��ͼ��ʾ�����仯ѧʽ�ɱ�ʾΪ____________��
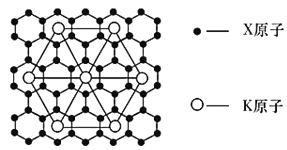
(5)Ԫ��Y��Ԫ��Z�γɵľ���ṹ��ͼ��ʾ���辧���������Y��������Z�ľ���Ϊa pm���û������Ħ������Ϊb g/ mol����þ����ܶȵļ���ʽΪ_________g/cm3
���𰸡�ds 1s22s22p63s23p43d104s2 ������  sp2 7��6.02��1023�� KC8
sp2 7��6.02��1023�� KC8 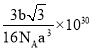 ��
��
��������
X��Y��Z��MΪԪ�����ڱ�ǰ�����ڵ�Ԫ�أ�Xԭ�Ӻ����L���������K�����������������X��2�����Ӳ㣬����������Ϊ4����XΪCԪ�أ�Y���ڲ��������������������9����Yֻ�ܴ��ڵ������ڣ�����������ֻ��Ϊ2���ڲ��������Ϊ18�������������Ϊ20����YΪCaԪ�أ�Z��Ԫ�����ڱ��ĸ�Ԫ���е縺�������ZΪFԪ�أ�WԪ�صĵ������Ӳ㴦��ȫ����״̬�ҵ��ĵ��Ӳ�ֻ��2�����ӣ���W��������Ϊ2+8+18+2=30����WΪZn��
��1��WΪZn����ds��Ԫ�أ����̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p43d104s2���ʴ�Ϊ��ds��1s22s22p63s23p43d104s2��
��2��WΪZn���백�������γ�������Ϊ��[Zn(NH3)4]2+����������Ϊ�������ӣ�NH3������Nԭ�ӳ�3��NH����������1�Թ¶Ե��ӣ��ӻ������Ϊ4����ȡsp3�ӻ�����NH3����Ϊ�����Σ�[Zn(NH3)4]2+��Zn2+�пչ����N�й¶Ե��ӣ��������ӵĽṹ��ʽΪ ���ʴ�Ϊ�������Σ�
���ʴ�Ϊ�������Σ� ��
��
��3��XΪCԪ�أ���CO(NH2)2���ӵĽṹ��ʽΪ![]() �����Ը÷�����̼ԭ�ӵ��ӻ���ʽΪsp2�ӻ���ÿ�������к���7������������1mol�����к���7mol�������ʴ�Ϊ��sp2�� 7��6.02��1023����
�����Ը÷�����̼ԭ�ӵ��ӻ���ʽΪsp2�ӻ���ÿ�������к���7������������1mol�����к���7mol�������ʴ�Ϊ��sp2�� 7��6.02��1023����
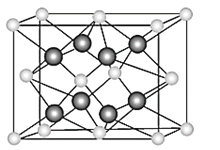
��4������ȡ������ԭ���γɵ�С������Ϊ���㵥λ������ȫռ�е�̼ԭ������4��ռ�еļ�ԭ����Ϊ1/6��3=1/2����̼ԭ�����ͼ�ԭ����֮����4:1/2=8:1��X��ij�־����仯ѧʽʱ��ʾΪKC8���ʴ�Ϊ��KC8��
��5����߳�Ϊxpm�����·����ƽ�棺�����ϵ��桢�µ��桢�м�4����ɫ�ɵ�2��ƽ�桢4���������棬��5����֮��ľ������Ϊ1/4xpm��ͬ�������ҷ����γɵ����ľ������Ϊ1/4xpm����a�����Ҳ���ľ���Ϊ1/4xpm����a�����µ��������ߣ�����Ϊo������oc��ֱ�⣬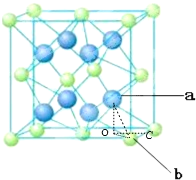 ����ocΪ1/4xpm��bc��Ϊ1/4xpm��ao��Ϊ1/4xpm��ab����ľ���
����ocΪ1/4xpm��bc��Ϊ1/4xpm��ao��Ϊ1/4xpm��ab����ľ���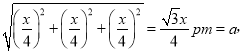 ����x=
����x=![]() pm��Ԫ��Ca��Ԫ��F�γɾ��壬��������ɫ����Ŀ=8��1/8+6��1/2=4����ɫ��Ϊ8�����ʻ�ѧʽΪCaF2���û������Ħ������Ϊbg/mol����������=4��
pm��Ԫ��Ca��Ԫ��F�γɾ��壬��������ɫ����Ŀ=8��1/8+6��1/2=4����ɫ��Ϊ8�����ʻ�ѧʽΪCaF2���û������Ħ������Ϊbg/mol����������=4��![]() g�������߳�Ϊxpm�������=(x��1010cm)3=x3��1030cm3=
g�������߳�Ϊxpm�������=(x��1010cm)3=x3��1030cm3=![]() cm3�����ܶ�Ϊ��
cm3�����ܶ�Ϊ�� ���ʴ�Ϊ��
���ʴ�Ϊ��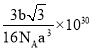 ��
��


 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д� Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��Ŧ�۵�����ִ�������Ӧ�ù㷺����һ����п��أ���缫�ֱ���Ag2O��Zn���������ҺΪKOH��Һ���ܷ�Ӧ��Zn��Ag2O��ZnO��2Ag����ش��������⡣

��1���õ������__________��أ�����һ������������������
��2��������_________���缫��Ӧʽ��______��
��3��ʹ��ʱ����������pH_______������������������С����������������
��.��4����ʵ֤��������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ�����л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص���_____��������ĸ��
A C��s��+H2O��g��=CO��g��+H2��g������H>0
B NaOH��aq��+HC1��aq��=NaC1��aq��+H2O��1������H<0
C 2CO��g��+O2��g��=2CO2��1������H<0
��5����KOH��ҺΪ�������Һ��������ѡ��Ӧ���һ��ԭ��أ��为���ĵ缫��ӦʽΪ_____��
��.�Ҵ���C2H5OH��ȼ�ϵ�أ�DEFC�����кܶ��ŵ㣬���������ǵ��о���Ȥ���������������Ҵ�ȼ�ϵ�ء�

��6�������Ҵ�ȼ�ϵ����������Ӧ���Ϊ_________�����ѧʽ��
��7���������Ҵ�ȼ�ϵ������ѡ������̼���Ϊ���ʣ���ع���ʱ��CO32����缫___������a������b�����ƶ���
��8�������Ҵ�ȼ�ϵ���У���������ı�״����2.24L O2�����·��ͨ���˵ĵ�����ĿΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2NO2(g)![]() 2NO(g)+O2(g)������̶����ܱ������н��У��ﵽƽ��״̬�ı�־��
2NO(g)+O2(g)������̶����ܱ������н��У��ﵽƽ��״̬�ı�־��
����λʱ��������1 mol O2��ͬʱ����2 mol NO2
����λʱ��������1 mol O2��ͬʱ����2 mol NO
����NO2��NO��O2��ʾ�ķ�Ӧ����֮��Ϊ2��2��1��״̬
������������ɫ���ٸı��״̬ �����������ܶȲ��ٸı��״̬
����������ѹǿ���ٸı��״̬ ����������ƽ����Է����������ٸı��״̬
A. �٢ܢޢ� B. �ڢۢݢ� C. �٢ڢۢܢ� D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȼ�շ��ⶨij�ְ�����(CxHyOzNm)�ķ�����ɡ�ȡWg���ְ�������ڴ����г��ȼ�գ����ɶ�����̼��ˮ�͵���������ͼ��ʾװ�ý���ʵ�顣

�ش��������⣺
��1��ʵ�鿪ʼʱ������ͨ��һ��ʱ�����������������__________________��
��2������װ������Ҫ���ȵ�������_______ (��д��ĸ)������ʱӦ�ȵ�ȼ_____���ľƾ��ơ�
��3��Aװ���з�����Ӧ�Ļ�ѧ����ʽ��____________________________��
��4��Dװ�õ�������____________________________��
��5����ȡ���������ʱ��Ӧע����_________________����_________________��
��6��ʵ���в�õ��������ΪVmL(��״��)��Ϊȷ���˰�����ķ���ʽ������Ҫ���й�������____________________��
A�����ɶ�����̼���������
B������ˮ������
C��ͨ�����������
D�����������Է�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״������ǿ��������õ�һ������Դ����֪��
��2H2(g)+O2(g)=2H2O(l) ��H1=-571.8 kJ/mol��
��CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ��H2=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ��H2=-192.9 kJ/mol
(1)��ʾ�״���ȫȼ���ȵĵ��Ȼ�ѧ����ʽΪ________________��
(2)��Ӧ���е������仯��ͼ��ʾ������H2=__________��(��E1��E2�����ʽ�ӱ�ʾ)��

(3)��̼����(��Ҫָ����CO2�ڽ������������ŷ��о�����Ҫ�����á�ĿǰNH3��(NH4)2CO3�Ѿ���������ҵ��̼��,������CO2�ɷ������·�Ӧ��
��Ӧ��2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ��H1
(NH4)2CO3(aq) ��H1
��Ӧ��NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ��H2
NH4HCO3(aq) ��H2
��Ӧ��: (NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ��H3
2NH4HCO3(aq) ��H3
����H3����H1 ����H2��֮��Ĺ�ϵΪ��H3 =_________��
(4)��1mol��̬������ij�ֹ��ۼ���Ҫ���յ������м��ܡ��ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ƿ�Ӧ��Ļ�ѧ�����ƻ���������Ļ�ѧ�����γɹ��̡��ڻ�ѧ��Ӧ�����У���ѧ����Ҫ�����������γɻ�ѧ���ֻ��ͷ�������
��ѧ�� | H��H | N��H | N��N |
����/kJ/mol | 436 | 391 | 945 |
��֪��ӦN2(g)+3H2(g)![]() 2NH3(g) ��H=akJ/mol���Ը��ݱ������м������ݹ���a��ֵ______��(ע����+����������)��
2NH3(g) ��H=akJ/mol���Ը��ݱ������м������ݹ���a��ֵ______��(ע����+����������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�ͼ��ʾԭ��ص�������ȷ����
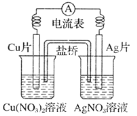
A.�����ص�����CuƬ����AgƬ
B.�����ĵ缫��Ӧ��Ag����e����Ag
C.CuƬ�Ϸ�����ԭ��Ӧ��AgƬ�Ϸ���������Ӧ
D.��Ӧʱ�����е�����������Cu(NO3)2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾij���淴Ӧ��ʹ�ú�δʹ�ô���ʱ����Ӧ���̺������Ķ�Ӧ��ϵ������˵��һ����ȷ����
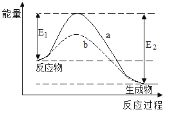
A.�÷�ӦΪ���ȷ�Ӧ
B.a��b��ȣ�a�ķ�Ӧ���ʸ���
C.a��b��ȣ���Ӧ��ƽ�ⳣ��һ����ͬ
D.E2����E1��˵��������������ȷ�Ӧ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CF3COOHˮ��Һ�н�����ֱ��ת��ΪCH3OH�ķ�Ӧ������ͼ������˵����ȷ����
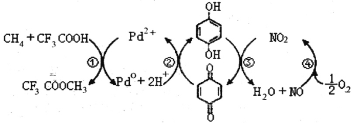
A.��������Ԫ�ص�һ�����ܣ�C<N<O<F
B.��Ӧ�۵�������Ϊ�Ա�����
C.�˷��ɼ�����ȡ�״��ķ���ʽΪ��2CH4+O2 2CH3OH
2CH3OH
D.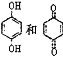 ��������Ũ��ˮ��Ӧ���ҷ�Ӧ������ͬ
��������Ũ��ˮ��Ӧ���ҷ�Ӧ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ݹ����ŵIJ�ͬ�������л�����з���(�����)��

(1)��������_____________ ��
(2)±������_____________��
(3)����_______________ ��
(4)�ӣ�_____________��
(5)ȩ��_______________ ��
(6)ͪ��_____________��
(7)���_____________ ��
(8)����_____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com