
氢能源是一种重要的清洁能源。现有两种可产生H2的固体化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)乙的电子式是__________。
(2)甲可在加热时将二氧化碳还原为甲烷,其化学方程式是 。
(3)乙在加热条件下与CuO反应可生成Cu和气体单质丙,写出该反应的化学方程式 。
(4)甲与乙之间能发生反应产生H2,判断理由是 。
(1)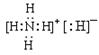
(2)4AlH3+3CO2 3CH4+2Al2O3
3CH4+2Al2O3
(3)2NH4H+5CuO 5Cu+ N2↑+5H2O
5Cu+ N2↑+5H2O
(4)AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2。
解析试题分析:“单质气体丙在标准状态下的密度为1.25 g/L”则丙的相对分子质量=1.25×22.4=28,所以丙为N2。化合物乙分解得到H2和N2,由于乙是固体,所以化合物乙为NH4H,NH4H由NH4+和H—构成的离子化合物。6.00 g化合物甲分解得到短周期元素的金属单质和6.72L÷22.4L/mol=0.3 molH2。根据质量守恒定律可知,该短周期元素的金属单质的质量为6.00g-0.2mol×2g/mol=5.40g;化合物甲与水反应生成的白色沉淀可溶于NaOH溶液,说明该沉淀可能是Al(OH)3,因此该金属元素是铝,所以可判定化合物甲为AlH3。涉及的反应为:a.甲、乙受热分解:2AlH3 2Al+3H2↑ 2NH4H
2Al+3H2↑ 2NH4H N2↑+5H2↑;b.甲与水反应: 2AlH3+6H2O==2Al(OH)3+6H2↑;c. 2NH4H+5CuO
N2↑+5H2↑;b.甲与水反应: 2AlH3+6H2O==2Al(OH)3+6H2↑;c. 2NH4H+5CuO 5Cu+ N2↑+5H2O。
5Cu+ N2↑+5H2O。
(1)化合物乙为NH4H,NH4H由NH4+和H—构成的离子化合物,其电子式为 。
。
(2)AlH3可在加热时将二氧化碳还原为甲烷,则根据原子守恒可知,另外一种生成物应该是氧化铝,所以其化学方程式是4AlH3+3CO2 3CH4+2Al2O3。
3CH4+2Al2O3。
(3)NH4H在加热条件下与CuO反应可生成Cu和气体单质氮气,因此根据原子守恒可知,还有水生成,所以该反应的化学方程式 2NH4H+5CuO 5Cu+ N2↑+5H2O。
5Cu+ N2↑+5H2O。
(4)由于AlH3中氢元素的化合价为-1价,—1价H还原性很强,NH4H中含有+1价的氢元素,具有氧化性,所以二者可发生氧化还原反应产生H2。
考点:考查根据物质的性质及其计算进行推理,以及化学式、电子式、化学方程式的正确书写


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:填空题
下图是由一些常见元素组成的单质及其化合物之间的转化关系图。常温常压下,D、F均为无色无味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体;G是一种红褐色沉淀,且G、H、I、J中都含有同一种元素(反应中生成的部分物质已略去)。请回答下列问题: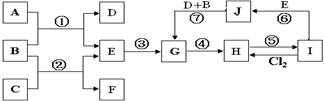
从反应②的实验现象可以得出物质C具有的某些物理性质有(写两点): 。
(2)J暴露在空气中的现象是 。
(3)①--⑦的反应中属于非氧化还原反应的有 。
(4)反应①的化学方程式为 。
(5)将115g甲酸(HCOOH)完全燃烧后的产物通过足量的固体A中,固体A将增重 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:A、B、C为中学常见的单质,A为淡黄色固体;D、E、F、M为中学常见的氧化物,E是磁铁矿的主要成分(是黑色固体);H、K为中学常见的盐;M是一种常见的无色液体。各物质间的转化关系如下图所示(某些条件已略去)。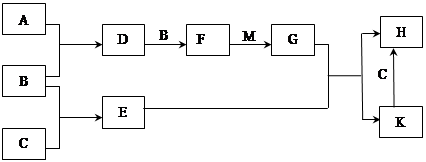
请回答:
(1)物质H的化学式为 。
(2)由F与M作用生成G的化学反应基本类型为 。
(3)A与C在加热条件下反应的化学方程式为: 。
(4)G的浓溶液在加热条件下能跟C反应,该反应中G体现了 (填序号)。
A.氧化性 B.还原性 C.漂白性 D.酸性
(5)若先将D气体通入BaCl2溶液中,再通入NH3,实验过程中的现象为 。
(6)H溶液在空气中长期放置会出现红褐色浑浊,请用一个离子方程式表示其变化的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E是中学常见的几种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。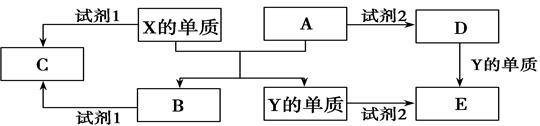
回答下列问题:
(1)X的单质与A反应的化学方程式是________________________________。
(2)若C溶液显碱性,则试剂1是 ____溶液(写化学式);若C溶液显酸性,则显酸性的原因是(用离子方程式表示) 。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是 ;
②写出D→E反应的离子方程式 ;
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系: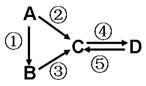
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。写出其中D与水反应生成的酸名称 。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写③反应的化学方程式 。
(3)若D物质具有两性, ② ③ 反应均要用强碱溶液,④ 反应是通入过量的一种引起温室效应的主要气体。写④ 反应离子方程式 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出② 反应的化学方程式 。
(5)若A是应用最广泛的金属。④ 反应用到A,② ⑤ 反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在下列物质转化关系中,反应的条件和部分产物已略去。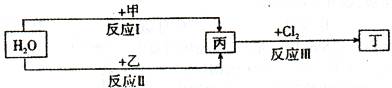
回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅰ是工业制盐酸的反应。
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,
则工业上生产甲的一般方法是_ 。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应a的化学方程式是
③通过比较反应I、II的反应条件,可得出甲的金属性比乙的金属性_ (填“强”或“弱”)。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应II是化合反应。目前常用乙作为燃煤的脱硫剂,则乙脱硫的主要反应的化学方程
式是
②在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离
子方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体单质,各物质有以下的转化关系(部分产物及条件略去)。Ks5u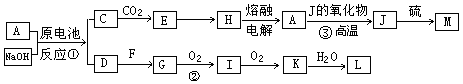
请回答以下问题:
(1)写出该原电池的总反应方程式_____________________。
(2)写出②的化学方程_________________。
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为 。(写出计算式)
(4)若③中J的氧化物为磁性氧化物,且每生成1mol J放出Q kJ的热量,请写出A→J反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢能源是一种重要的清洁能源。现有两种可产生 的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的
的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的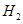 (已折算成标准状况)。甲与水反应也能产生
(已折算成标准状况)。甲与水反应也能产生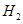 ,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到
,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到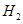 和另一种单质气体丙,丙在标准状态下的密度为1.25g·L-1。请回答下列问题:
和另一种单质气体丙,丙在标准状态下的密度为1.25g·L-1。请回答下列问题:
(1)甲的化学式是_________;乙的空间构型是__________。
(2)甲与水反应的化学方程式是__________________________________。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式________ 有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之
_________________________。
(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能)发生反应产生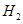 ,判断理由是
,判断理由是
_______ _ 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列陈述和判正确、并且有因果关系的是
| 选项 | 陈述 | 判断 |
| A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| B | 在未知溶液加入稀硝酸和氯化钡溶液有沉淀生成 | 说明该未知溶液肯定含有SO42- |
| C | 在金属活动顺序表中,金属活动顺序:Fe>H>Cu>Hg>Ag | 要从矿石中冶炼得到金属单质,汞和银只需加热,而铁和铜必须用还原剂 |
| D | 锌锰干电池碳棒是正极,MnO2是氧化剂 | 锌锰干电池是二次电池,可以反复充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com