
在下列物质转化关系中,反应的条件和部分产物已略去。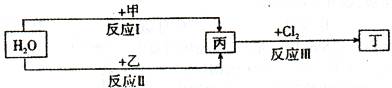
回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅰ是工业制盐酸的反应。
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,
则工业上生产甲的一般方法是_ 。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应a的化学方程式是
③通过比较反应I、II的反应条件,可得出甲的金属性比乙的金属性_ (填“强”或“弱”)。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应II是化合反应。目前常用乙作为燃煤的脱硫剂,则乙脱硫的主要反应的化学方程
式是
②在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离
子方程式是
17.(2)①C; ②3Fe+4H2O(g)=Fe3O4+4H2(g);③强;(2)①CaO + SO2 = CaSO3 +2CaSO4; ②2Cl2 + H2O + CaCO3 = Ca2+ + 2Cl- + 2HClO + CO2
解析试题分析:工业制备盐酸的反应,丙为H2,丁为HCl,(1)反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,该物质含有Na元素,故甲为Na,与水反应生成氢氧化钠,工业上制备钠采用电解法,故选C。②反应II中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙为Fe,处于周期表中第四周期第Ⅷ族,生成的磁性物质为Fe3O4,反应方程式为:3Fe+4H2O(g)=Fe3O4+4H2(g),故答案为:第四周期第Ⅷ族;3Fe+4H2O(g)=Fe3O4+4H2(g);③铁越水蒸气在高温条件下发生反应,钠与水在常温下剧烈反应,故金属性钠比铁强,最高价氧化物对应水化物碱性强弱比较金属性强弱,NaOH是强碱而Fe(OH)3是弱碱,说明金属性钠比铁强,故答案为:强;NaOH是强碱而Fe(OH)3是弱碱;
(2)①燃煤的脱硫剂,主要是把二氧化硫吸收,目前主要是方法是石灰石脱硫法,方程式如答案所示。②在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体应该是二氧化碳,方程式如答案所示。
考点:本题考查了元素推断,考查钠、铁元素单质的性质等、常用化学用语书写。


科目:高中化学 来源: 题型:填空题
Ⅰ.有关物质存在如图所示的转化关系(部分产物已省略)。通常B为黑色粉末,C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。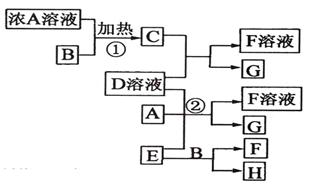
请回答下列问题:
(1)反应①的化学方程式为________________________________;
(2)反应②的离子方程式为________________________________ ;
(3)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。浓度为0.01mo1/L的D溶液与a mo1/L的Pb(NO3)2溶液等体积混合,则生成沉淀所需a的最小值为____________;
(4)电解F的溶液可以实现电能转化为化学能,请写出惰性电极电解足量的F溶液的离子方程式________________________________。
Ⅱ.辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是___________,当1mol O2发生反应时,还原剂所失电子的物质的量为______mol。向CuSO4溶液中加入镁条时有气体生成,该气体是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题: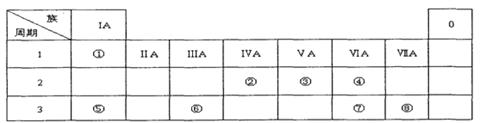
Ⅰ.(1)请画出元素⑧的阴离子结构示意图 。
(2)④、⑤、⑦的原子半径由小到大的顺序为 。
(3)⑤和⑥的最高价氧化物对应水化物的碱性强弱为 > 。
(4)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为 。
Ⅱ.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:
(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的方法是 ;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式 。
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,写出A与C两溶液反应的离子方程式____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图为中学常见物质间的转化关系,其中甲、乙、丙、丁为单质,其余为化合物,甲单质所含元素最外层电子数等于周期数,C常温下为无色液体,B焰色反应为黄色。一些在溶液中进行的反应溶液中的H2O及生成的H2O已省略。
回答下列问题: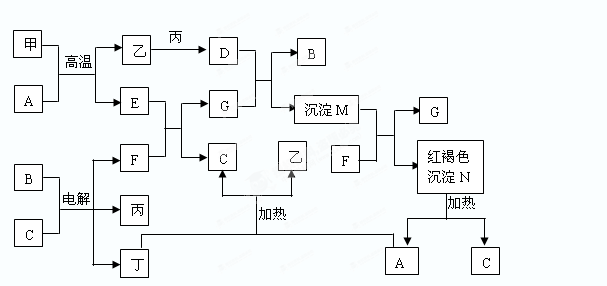
(1)单质乙所含元素在周期表中的位置______________________。
(2)化合物F的电子式________________________。
(3)D和G反应的离子方程式___________________________________。
(4)甲和A反应的化学方程式___________________________________。这类反应一般被称做________反应,该反应的主要应用_________________。(2种)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢能源是一种重要的清洁能源。现有两种可产生H2的固体化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)乙的电子式是__________。
(2)甲可在加热时将二氧化碳还原为甲烷,其化学方程式是 。
(3)乙在加热条件下与CuO反应可生成Cu和气体单质丙,写出该反应的化学方程式 。
(4)甲与乙之间能发生反应产生H2,判断理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
中学化学常见物质A在一定条件下发生如下反应:A+B→E+F+H2O(未配平)
(1)若A为小苏打,F为气体。该反应的离子方程式为 。
(2)若A为紫红色金属单质,气体F是由两种位于同一主族的短周期元素组成。则E的化学式为________。
(3)若A是磁铁矿的主要成分,B是盐酸。写出反应的化学方程式为 。
(4)若A为黄绿色气体单质,F的碱性溶液吸收废气中SO2的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化如下图所示(部分产物已略去)。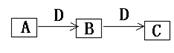
请按要求回答下列问题:
(1)若B、C 为氧化物,C能够与水反应生成一种强酸E。
①当B为无色易溶于水的刺激性气体时,写出B转化为C的化学方程式: ;
②当B为无色不溶于水的气体时, F由A与E化合生成。当小心加热F时,可得到一种无色无味的气体G(G和CO2具有相同的原子数目和电子数目)和一种无色无味的液体H,写出F分解生成G和H的化学方程式 ;
(2)若D为氧化物,A、B、C都是强电解质,C可用于食品发酵、泡沫灭火。写出A与D反应的离子方程式: ;
(3)若D为强酸或强碱溶液时都能发生图示转化关系,且A和C在溶液中反应生成白色沉淀B。
当D为强酸时,A→B反应的离子方程式: ;
当D为强碱时,B→C反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
中学常见反应的化学方程式是:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,该反应的离子方程式是 。
(2)若A为常见的非金属单质,B的溶液为某浓酸,其氧化产物的结构式为 ______
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是 (填所在周期和族)
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,被还原的X
是 mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知一定条件下A、B、C、D之间的转化关系如下图所示。下列说法正确的是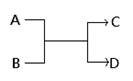
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com