
【题目】二甲醚(CH3OCH3)燃料电池的工作原理如右图,有关叙述正确的是

A. 该装置能实现化学能100%转化为电能
B. 电子移动方向为:a极→b极→质子交换膜→a极
C. a电极的电极反应式为:CH3OCH3+3H2O=2CO2+12e-+12H+
D. 当b电极消耗22.4LO2时,质子交換膜有4moIH+通过
【答案】C
【解析】燃料电池中通入燃料的一极为负极,负极上二甲醚失电子生成二氧化碳和氢离子,则负极的电极反应式为:CH3OCH3+3H2O-12e-═2CO2+12H+,通入氧气的一极为正极,即B电极为正极;溶液中阳离子向正极移动,即H+从A移向B;
A、能量的转化率很难达到100%,该装置不能实现化学能100%转化为电能,故A错误;B、电子不在溶液中移动,故B错误;C、燃料电池中通入燃料的一极为负极,负极上二甲醚失电子生成二氧化碳和氢离子,则负极的电极反应式为:CH3OCH3+3H2O-12e-═2CO2+12H+,故C正确;D、当b电极消耗22.4LO2时,没有强调气体为标准状况,故D错误;故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是

A. X→Y反应类型为酯化反应
B. X、Y、Z均能使溴的四氯化碳溶液褪色
C. Y和Z互为同分异构体
D. 等物质的量的X、Z分别与足量Na反应,消耗Na的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOH和CH3COOCH3互为同系物B.氧气和臭氧互为同位素
C.C5H12有四种同分异构体D.金刚石和石墨互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组在帮助老师整理实验室的化学试剂时,发现一盛无色盐溶液的试剂瓶,标签破损如右图,该小组根据已掌握的知识,对药品作出猜想,并设计实验验证。

(1)该实验药品为中学化学常用试剂,推测它的阳离子化合价为______________________。
(2)同学们做出以下三种推测。
猜想1:Na2SO4
实验设计: 进行……,.证明是Na2SO4溶液;
猜想2: K2SO4
实验设计:____________________________,证明是K2SO4溶液;
猜想3; (NH4)2SO4
实验设计:____________________________,证明是(NH4)2SO4溶液。
(3)通过实验发现“猜想3”成立,已知(NH4)2SO4受热易分解,该小组拟用下图所示装置探究其分解产物。(夹持和加热装置略)

实验I:装置B 盛0.5000mol/L盐酸50.00mL,通入N2排尽空气后,将装置A 加热至260℃一段时间,停止加热,停止通入N2,品红溶液不褪色,取下装置B,用0.1000mol/LNaOH溶液滴定剩余盐酸,消耗NaOH 溶液50.00mL。经检验滴定后的溶液中无SO42-。

①请从右图选择盛放0.1000mol/LNaOH 溶液的滴定管____________(填“甲”或“乙”)。
②装置B 内溶液吸收气体的物质的量是_____________________mol。
实验Ⅱ:通入N2排尽空气后,将装置A 加热到400℃,至固体无残留,停止加热,停止通入N2,观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。
①装置E 的作用是____________________________。
②A、D之间的导气管内的少量白色固体是____________________________。
③有同学提出在AD之间需要增加一个防倒吸的安全瓶,老师说不需要,原因是____________________________。
④进一步研究发现,气体产物中无氮氧化物,则(NH4)2SO4在400℃分解的化学方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过量的锌粉与一定量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是
A.加入适量的水B.加入氯化钠溶液
C.加入少量CuSO4溶液D.加入等体积的浓度较大的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水CaCl2具有强烈的吸湿性,在空气中易潮解,可用作干燥剂、脱水剂、混凝防冻剂等。以工业碳酸钙矿石(含有少量SiO2 、Fe2O3、Al2O3、FeCO3等杂质)生产无水氯化钙的主要流程如下:
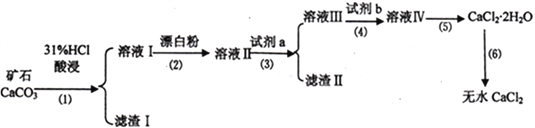
(1)为了提高步骤(1)的反应速率,可以采取的措施是________________________。
(2)加入试剂b 的目的是使溶液酸化,试剂b 可以选择下列试剂__________(填序号)。
①硫酸 ②硝酸 ③氢硫酸 ④盐酸
(3)写出步骤(2)的离子方程式______________________________。
(4)步骤(5)用到的操作方法有蒸发浓缩、______________________________。
(5)已知A13+、Fe2+、Fe3+生成氢氧化物沉淀的pH 如下:
Al (OH)3 | Fe(OH)2 | Fe(OH)3 | |||
开始沉淀 | 3.7 | 开始溶解 | 7.8 | 6.5 | 1.5 |
沉淀完全 | 5.3 | 完全溶解 | 10.0 | 9.7 | 3.3 |
加入试剂a的目的是调节溶液的pH,调节pH 的范围为_______________________________。
(6)已知某一温度时Ksp[Fe(OH)3]=8.0×10-38,向0.01 mol·L-1的FeCl3 溶液中加入NaOH 固体,假设溶液的体积不变,要生成Fe(OH)3沉淀,应使溶液中的c(OH-)最小为__________mol·L-1;Fe3+沉淀完全时,溶液中c(OH-) 最小为__________mol·L-1。
(7)测定样品中Cl-含量的方法是:a.称取0.7500g 样品,溶解,在250mL 容量瓶中定容;b.量取25.00mL 待测液于锥形瓶中; c.用0.05000mol·L-1AgNO3 溶液滴定至终点,消耗AgNO3溶液体积的平均值为25.00mL。计算上述样品中CaCl2 的质量分数为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化曲线如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述正确的是
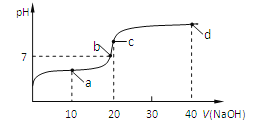
A.a点时:c(CH3COOH) c(CH3COO-) c(H+) c(Na+) c(OH-)
B.b点时:c(Na+)=c(CH3COO-)
C.c点时:c(H+)=c(CH3COOH)+c(OH-)
D.d点时:c(Na+) c(OH-) c(CH3COO-) c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.花生油的主要成分是高级脂肪酸甘油酯,属于高分子化合物
B.汽油和食用油都可以在碱性条件下水解
C.脱脂棉、滤纸的主要成分均为纤维素,完全水解能得到葡萄糖
D.钠与乙醇反应时钠浮在液面上,反应比钠与水反应更剧烈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com