
【题目】某化学学习小组在帮助老师整理实验室的化学试剂时,发现一盛无色盐溶液的试剂瓶,标签破损如右图,该小组根据已掌握的知识,对药品作出猜想,并设计实验验证。

(1)该实验药品为中学化学常用试剂,推测它的阳离子化合价为______________________。
(2)同学们做出以下三种推测。
猜想1:Na2SO4
实验设计: 进行……,.证明是Na2SO4溶液;
猜想2: K2SO4
实验设计:____________________________,证明是K2SO4溶液;
猜想3; (NH4)2SO4
实验设计:____________________________,证明是(NH4)2SO4溶液。
(3)通过实验发现“猜想3”成立,已知(NH4)2SO4受热易分解,该小组拟用下图所示装置探究其分解产物。(夹持和加热装置略)

实验I:装置B 盛0.5000mol/L盐酸50.00mL,通入N2排尽空气后,将装置A 加热至260℃一段时间,停止加热,停止通入N2,品红溶液不褪色,取下装置B,用0.1000mol/LNaOH溶液滴定剩余盐酸,消耗NaOH 溶液50.00mL。经检验滴定后的溶液中无SO42-。

①请从右图选择盛放0.1000mol/LNaOH 溶液的滴定管____________(填“甲”或“乙”)。
②装置B 内溶液吸收气体的物质的量是_____________________mol。
实验Ⅱ:通入N2排尽空气后,将装置A 加热到400℃,至固体无残留,停止加热,停止通入N2,观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。
①装置E 的作用是____________________________。
②A、D之间的导气管内的少量白色固体是____________________________。
③有同学提出在AD之间需要增加一个防倒吸的安全瓶,老师说不需要,原因是____________________________。
④进一步研究发现,气体产物中无氮氧化物,则(NH4)2SO4在400℃分解的化学方程式是_______________________________。
【答案】 +1 进行焰色反应,透过蓝色钴玻璃观察,火焰呈紫色 取一定量溶液于试管中加浓NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体 乙 0.02 吸收NH3 (NH4)2SO3 (NH4)2SO4分解过程中不断通入N2,从而稀释了SO2起到了阻止倒吸的作用 3(NH4)2SO4![]() 4NH3↑+ N2↑+3SO2↑ + 6H2O↑
4NH3↑+ N2↑+3SO2↑ + 6H2O↑
【解析】试题分析:本题考查常见阳离子的检验,探究(NH4)2SO4分解的产物,滴定实验和实验的评价,化学方程式的书写。
(1)根据破损的标签,该无色盐的化学式为M2SO4(M代表其中的阳离子),S元素的化合价为+6价,O元素的化合价为-2价,根据化合物中元素正负化合价代数和为0,阳离子的化合价为+1价。
(2)猜想2,试剂瓶中为K2SO4溶液,证明阳离子为K+用焰色反应。实验设计:进行焰色反应,透过蓝色钴玻璃观察,火焰呈紫色,证明是K2SO4溶液。
猜想3,试剂瓶中为(NH4)2SO4溶液,证明阳离子为NH4+利用的反应原理为:NH4++OH-![]() NH3↑+H2O,NH3能使湿润的红色石蕊试纸变蓝。实验设计:取一定量溶液于试管中加浓NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明是(NH4)2SO4溶液。
NH3↑+H2O,NH3能使湿润的红色石蕊试纸变蓝。实验设计:取一定量溶液于试管中加浓NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明是(NH4)2SO4溶液。
(3)实验I:①甲为酸式滴定管,乙为碱式滴定管,盛放NaOH溶液选用碱式滴定管,答案选乙。
②加热(NH4)2SO4到260℃时不产生使品红溶液褪色的气体,没有SO2生成,滴定后的溶液中无SO42-,没有SO3生成,则装置B中盐酸吸收分解产生的NH3;根据反应NaOH+HCl=NaCl+H2O,n(HCl)剩余=n(NaOH)=0.1000mol/L![]() 0.05L=0.005mol,吸收NH3消耗HCl物质的量为0.5000mol/L
0.05L=0.005mol,吸收NH3消耗HCl物质的量为0.5000mol/L![]() 0.05L-0.005mol=0.02mol,根据反应NH3+HCl=NH4Cl,装置B内溶液吸收气体物质的量为0.02mol。
0.05L-0.005mol=0.02mol,根据反应NH3+HCl=NH4Cl,装置B内溶液吸收气体物质的量为0.02mol。
实验II:①装置D内溶液中有SO32-,没有SO42-,说明加热(NH4)2SO4到400℃时分解产生了SO2;装置A、D之间的导气管内有少量白色固体,该白色固体中含SO32-,说明(NH4)2SO4分解还产生了NH3和H2O;装置D中NaOH溶液吸收SO2,装置E中水吸收NH3。
②(NH4)2SO4加热到400℃分解生成的NH3、SO2和H2O在A、D之间的导管内发生化合反应生成白色固体(NH4)2SO3,反应的化学方程式为2NH3+SO2+H2O=(NH4)2SO3。
③在A、D之间不需要增加防倒吸的安全瓶的原因是:虽然SO2易溶于水,但(NH4)2SO4分解过程中不断通入N2,N2难溶于水,N2稀释了SO2起到了防止倒吸的作用。
④根据上述分析(NH4)2SO4加热到400℃分解生成了SO2、NH3和H2O,S元素的化合价由+6价降至+4价,根据得失电子守恒,只能为N元素的化合价升高,由于气体产物中无氮氧化物,说明生成N2,根据得失电子守恒和原子守恒,(NH4)2SO4在400℃分解反应的化学方程式为3(NH42SO4![]() 4NH3↑+ N2↑+3SO2↑+ 6H2O↑。
4NH3↑+ N2↑+3SO2↑+ 6H2O↑。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,下列各组离子在指定溶液中一定能大量共存的是 ( )
A. 能使紫色石蕊试液变红的溶液:Mg2+、Na+、NO3-、Cl-
B. 0.1 mol·L-1 NH4Cl溶液:Na+、Ca2+、OH-、CO32-
C. 0.1 mol·L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、I-
D. 与Al反应能产生H2的溶液:NH4+、SO42-、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用含有少量氯化钙的氯化钠固体,配制100 mL a mol·L-1的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:

(1)称量粗盐样品m g,在托盘天平左盘上放________,右盘上放_______。
(2)蒸发操作时应将液体放在________中加热,等加热至________时即停止加热。
(3)在样品的溶液中加入过量的Na2CO3溶液,作用是_________________________________,
反应的化学方程式是______________________________________________________。
(4)在滤液中加入盐酸的作用是____________________________________,
反应的化学方程式是____________________________________________。
(5)配制100 mL a mol·L-1的NaCl溶液时,应从W g固体中称取NaCl的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,①②③④分别是几种常见漏斗的上部,A、B、C、D是实际应用操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图(图中漏斗及容器中的药品均已略去,铁架台、铁夹也已略去)。请根据实际使用操作时上述漏斗的使用范围和它们的形状,指出A、B、C、D分别与①②③④中哪一种最为匹配:A与_____________,B与______________,C与_______________,D与_______________。
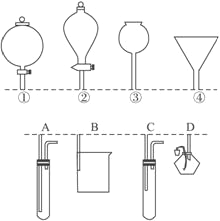
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 淀粉在人体内能水解成葡萄糖 B. 纤维素和淀粉遇碘水均呈蓝色
C. 葡萄糖和淀粉均属于高分子化合物 D. 凡含有食品添加剂的食物均不可食用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将 20.0 g 质量分数为 14.0%的 KNO3溶液与 30.0 g 质量分数为 24.0%的 KNO3溶液混合,得到的密度为1.15 g/cm3的混合溶液。计算:
(1)混合后溶液的质量分数_________。
(2)混合后溶液的物质的量浓度_______。
(3)在1000g水中需溶解______molKNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
(4)标况下44.8LHCl溶于水配成500mL溶液。计算:
①HCl的物质的量____________________;
②所得溶液中溶质的物质的量浓度____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)燃料电池的工作原理如右图,有关叙述正确的是

A. 该装置能实现化学能100%转化为电能
B. 电子移动方向为:a极→b极→质子交换膜→a极
C. a电极的电极反应式为:CH3OCH3+3H2O=2CO2+12e-+12H+
D. 当b电极消耗22.4LO2时,质子交換膜有4moIH+通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是
A.16O2与18O2互为同分异构体
B.16O和18O核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12L16O2和1.12L18O2均含0.1NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示则

A. M点所示溶液的导电能力强于Q点
B. N点所示溶液中c(CH3COO-)>c(Na+)
C. M点和N点所示溶液中水的电离程度相同
D. Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com