
【题目】16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是
A.16O2与18O2互为同分异构体
B.16O和18O核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12L16O2和1.12L18O2均含0.1NA个氧原子
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学学习小组在帮助老师整理实验室的化学试剂时,发现一盛无色盐溶液的试剂瓶,标签破损如右图,该小组根据已掌握的知识,对药品作出猜想,并设计实验验证。

(1)该实验药品为中学化学常用试剂,推测它的阳离子化合价为______________________。
(2)同学们做出以下三种推测。
猜想1:Na2SO4
实验设计: 进行……,.证明是Na2SO4溶液;
猜想2: K2SO4
实验设计:____________________________,证明是K2SO4溶液;
猜想3; (NH4)2SO4
实验设计:____________________________,证明是(NH4)2SO4溶液。
(3)通过实验发现“猜想3”成立,已知(NH4)2SO4受热易分解,该小组拟用下图所示装置探究其分解产物。(夹持和加热装置略)

实验I:装置B 盛0.5000mol/L盐酸50.00mL,通入N2排尽空气后,将装置A 加热至260℃一段时间,停止加热,停止通入N2,品红溶液不褪色,取下装置B,用0.1000mol/LNaOH溶液滴定剩余盐酸,消耗NaOH 溶液50.00mL。经检验滴定后的溶液中无SO42-。

①请从右图选择盛放0.1000mol/LNaOH 溶液的滴定管____________(填“甲”或“乙”)。
②装置B 内溶液吸收气体的物质的量是_____________________mol。
实验Ⅱ:通入N2排尽空气后,将装置A 加热到400℃,至固体无残留,停止加热,停止通入N2,观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。
①装置E 的作用是____________________________。
②A、D之间的导气管内的少量白色固体是____________________________。
③有同学提出在AD之间需要增加一个防倒吸的安全瓶,老师说不需要,原因是____________________________。
④进一步研究发现,气体产物中无氮氧化物,则(NH4)2SO4在400℃分解的化学方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水CaCl2具有强烈的吸湿性,在空气中易潮解,可用作干燥剂、脱水剂、混凝防冻剂等。以工业碳酸钙矿石(含有少量SiO2 、Fe2O3、Al2O3、FeCO3等杂质)生产无水氯化钙的主要流程如下:
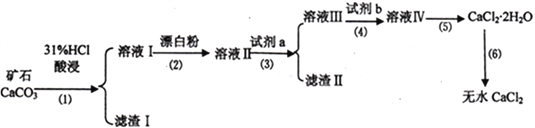
(1)为了提高步骤(1)的反应速率,可以采取的措施是________________________。
(2)加入试剂b 的目的是使溶液酸化,试剂b 可以选择下列试剂__________(填序号)。
①硫酸 ②硝酸 ③氢硫酸 ④盐酸
(3)写出步骤(2)的离子方程式______________________________。
(4)步骤(5)用到的操作方法有蒸发浓缩、______________________________。
(5)已知A13+、Fe2+、Fe3+生成氢氧化物沉淀的pH 如下:
Al (OH)3 | Fe(OH)2 | Fe(OH)3 | |||
开始沉淀 | 3.7 | 开始溶解 | 7.8 | 6.5 | 1.5 |
沉淀完全 | 5.3 | 完全溶解 | 10.0 | 9.7 | 3.3 |
加入试剂a的目的是调节溶液的pH,调节pH 的范围为_______________________________。
(6)已知某一温度时Ksp[Fe(OH)3]=8.0×10-38,向0.01 mol·L-1的FeCl3 溶液中加入NaOH 固体,假设溶液的体积不变,要生成Fe(OH)3沉淀,应使溶液中的c(OH-)最小为__________mol·L-1;Fe3+沉淀完全时,溶液中c(OH-) 最小为__________mol·L-1。
(7)测定样品中Cl-含量的方法是:a.称取0.7500g 样品,溶解,在250mL 容量瓶中定容;b.量取25.00mL 待测液于锥形瓶中; c.用0.05000mol·L-1AgNO3 溶液滴定至终点,消耗AgNO3溶液体积的平均值为25.00mL。计算上述样品中CaCl2 的质量分数为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知咖啡酸的结构如右图所示。关于咖啡酸的描述正确的是
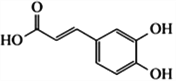
A. 与咖啡酸的官能团完全相同(不含咖啡酸),且苯环上只有3个取代基的同分异构体(不包括顺反异构)有11种
B. 咖啡酸的分子式为C9H6O4
C. 咖啡酸与![]() 互为同系物
互为同系物
D. 1mol 咖啡酸与足量NaHCO3溶液反应产生3mol 气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化曲线如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述正确的是
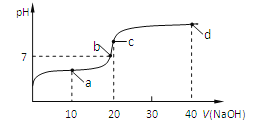
A.a点时:c(CH3COOH) c(CH3COO-) c(H+) c(Na+) c(OH-)
B.b点时:c(Na+)=c(CH3COO-)
C.c点时:c(H+)=c(CH3COOH)+c(OH-)
D.d点时:c(Na+) c(OH-) c(CH3COO-) c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
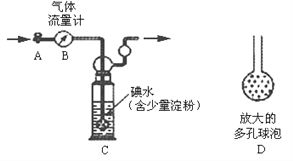
(1)洗气瓶C中发生反应的化学方程式为:_______________;
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:___________________;
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量将_________(填“偏高”、“偏低”或“无影响”);
(4)下列试剂中,可以用来替代洗气瓶C中溶液的是_________。(选填字母编号)
a.NaOH溶液 b.品红溶液
c.酸性高锰酸钾溶液 d.Na2CO3溶液
乙方案:实验步骤如以下流程图所示:
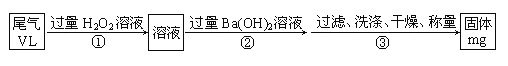
(5)写出步骤②中反应的离子方程式;_________________________
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为________________(用含V、m的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10﹣8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10﹣5 mol/L。若在10mL含有KCl和KI各为0.01mol/L的溶液中,加入16mL 0.01mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
A. c(K+)>c(NO3﹣)>c(Ag+)>c(Cl﹣)>c(I﹣)
B. c(K+)>c(NO3﹣)>c(Cl﹣)>c(Ag+)>c(I﹣)
C. c(K+)>c(NO3﹣)>c(Ag+)=c(Cl﹣)+c(I﹣)
D. c(NO3﹣)>c(K+)>c(Ag+)>c(Cl﹣)>c(I﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com