
【题目】X、Y、Z、R、W是5种短周期元素,它们的原子的最外层电子数与原子序数的关系如下图所示。下列说法正确的是( )

A. Y和W在同一主族 B. X和R在同一周期
C. Y的最高正化合价为+7 D. Z和O2反应的产物只有一种
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某短周期元素的原子最外层电子数是次外层电子数的3倍,那么该原子
A. 有3个电子层B. 有2个电子层
C. 最外层电子数是8D. 核电荷数是10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和其他无机原料合成环状酯E和高分子化合物H的示意图如下所示:
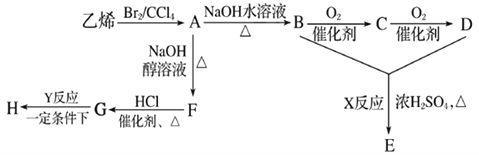
请回答下列问题:
(1)写出以下物质的结构简式:A___________,F___________,C___________。
(2)写出以下反应的反应类型:X_________________,Y__________________。
(3)写出以下反应的化学方程式:A→B:_______________;G→H:___________。
(4)若环状酯E与NaOH水溶液共热,则发生反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入体积不变的容器内各组分的物质的量见下表:
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入体积不变的容器内各组分的物质的量见下表:
CO2 | H2 | CO | H2O | |
甲 | 2a mol | 2a mol | 0 | 0 |
乙 | 2a mol | a mol | 0 | 0 |
丙 | 0 | 0 | 2a mol | 2a mol |
丁 | amol | 0 | a mol | a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙>丁>甲>丙 B. 乙=丁<丙=甲
C. 丁>乙>丙=甲 D. 丁>丙>乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解50mLCuSO4的溶液,两极上均收集到4.48L气体(标准状况),则原混合液中Cu2+物质的量浓度为
A. 1mol·L-1 B. 2 mol·L-1 C. 3mol·L-1 D. 4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeI2,FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。已知:2Fe2++Br2===2Fe3++2Br-,2Fe3++2I-===2Fe2++I2。则下列有关说法中,不正确的是( )。

A. 线段BD表示Fe3+物质的量的变化
B. 原混合溶液中FeI2的物质的量为1mol
C. 当通入2 mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D. 原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g)![]() pC(g)+qD(g),达到平衡后,温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度由0.15 mol·L-1变为原来的0.20mol·L-1,则下列叙述正确的是
pC(g)+qD(g),达到平衡后,温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度由0.15 mol·L-1变为原来的0.20mol·L-1,则下列叙述正确的是
A. m+n>p+q B. m+n<p+q
C. 平衡向正反应方向移动 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别是为石墨和铁。

试完成下列问题:
(1)a电极材料是_____。电解质溶液d若为______(填字母),则白色沉淀在电极上生成,此时a电极的电极反应式为_________________________;电解质溶液d若为____(填字母),则白色沉淀在两极之间的溶液中生成,若这种情况下,电路中有0.4mol电子通过,则理论上生成Fe(OH)2的质量为_______g。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(2)液体c为苯,所起的作用是__________________________,在加入苯之前,对d溶液进行加热处理的目的是__________________。
(3)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为________,发生反应的方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列关于该装置的四种说法,正确的组合是

①.a为直流电源的负极
②.阴极的电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O
③.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+
④.电解时,H+由阴极室通过阳离子交换膜到阳极室
A. ①和② B. ①和③
C. ②和③ D. ③和④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com