
【题目】用石墨电极电解50mLCuSO4的溶液,两极上均收集到4.48L气体(标准状况),则原混合液中Cu2+物质的量浓度为
A. 1mol·L-1 B. 2 mol·L-1 C. 3mol·L-1 D. 4 mol·L-1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴入新制氯水后,混合溶液变成红色,则下列结论错误的是( )
A. 该溶液中一定含有SCN- B. 氧化性:Fe3+>Cl2
C. Fe2+与SCN-不能形成红色物质 D. Fe2+被氧化为Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能大量共存于同一溶液中的离子组是( )
A.Ba2+、K+、SO42— B.Ca2+、NO3—、Cl—
C.Na+、Mg2+、OH— D.H+、Cl—、HCO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是中学化学实验室的常见药品,回答下列实验问题。
Ⅰ.配制一定物质的量浓度的硫酸溶液:
(1)某次实验大约需要1mol/L硫酸溶液435ml。同学们发现实验室内没有450ml的容量瓶,某同学提议用1个200ml容量瓶和1个250ml容量瓶来配制,你认为该提议_________(填“合理”、“不合理”)。
(2)实验中要配制0.5mol/L H2SO4溶液250ml。则需量取密度为1.84g/ml、98%的浓硫酸________ml。
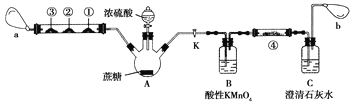
Ⅱ.蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体,会对环境造成污染。某实验小组利用如下装置对该实验进行改进。回答下列问题:
注:硬质玻璃管中①、②、③处分别为滴有Na2S溶液的滤纸、滴有品红溶液的滤纸、滴有酸性KMnO4溶液的滤纸,a和b分别为两个小气球。
(1)图中盛装浓硫酸的仪器名称为________________。
(2)实验开始后先关闭活塞K,硬质玻璃管中①号试纸变黄,②号和③号滤纸均褪色,a处气球变大。硬质玻璃管中实验现象说明炭化实验产生的刺激性气味气体是SO2,①、②、③处发生的变化分别说明SO2具有_____________、_____________和_____________(填SO2表现出的性质)。
(3)打开活塞K,a处气球变小,b处气球变大。使三颈烧瓶内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊。为证明有CO2生成,可以在④号位置的滤纸滴加______________溶液,该试剂的作用是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W是5种短周期元素,它们的原子的最外层电子数与原子序数的关系如下图所示。下列说法正确的是( )

A. Y和W在同一主族 B. X和R在同一周期
C. Y的最高正化合价为+7 D. Z和O2反应的产物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛矿工业中会排放出酸性废水。含石TiO2+、Fe2+、Fe3+离子,其综合利用如下:

已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)写出步骤Ⅰ发生反应的离子方程式___________。
(2)步骤Ⅰ后所得溶液中Fe2+的检验方法是___________。
(3)从溶液中得到FeSO4·7H2O的操作是___________、___________、过滤、洗涤。步骤Ⅲ中反应温度一般需控制在35℃以下,其目的是___________。
(4)步骤Ⅳ发生反应的化学方程式为___________。
(5)步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6mol·L-1。试判断所得的FeCO3中___________(填“有”或“没有”)(己知Fe(OH)2(已知Fe(OH)2的Ksp为8×10-16)
(6)向“富TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O。请用化学原理解释其原因。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.过氧化钡常温下缓慢分解,不溶于水,常用作氧化剂、漂白剂等。请回答下列问题:
(1)BaO2的电子式为 __________________。
(2)BaCl2在氨水中与H2O2反应可得到BaO2沉淀,用一个离子反应方程式表示该原理为__________________________________________。
(3)配平下列反应方程式: (____)MnO4- + ( ) BaO2+= ( ) Ba2++ ( ) Mn2++ ( ) O2+ ( ) H2O
II、化合物甲由三种元素组成,某研究性学习小组按如下流程探究其组成:

已知:气体A能使品红溶液褪色,加热后品红溶液恢复至原色。取少量溶液B,滴加KSCN溶液,发现溶液变为血红色。请推测并回答:
(4)用离子反应方程式解释溶液变为血红色的原因:____________________________。
(5)写出形成溶液C的化学方程式:________________________________________。
(6)写出气体A通入溶液B中,发生氧化还原的离子反应方程式:_______________________。
(7)写出化合物甲的化学式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:
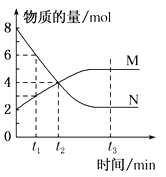
(1)该图形所描述的反应的化学方程式是______________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻处于平衡状态,此时v正____v逆(填>、<或=)。
(3)下列描述中能说明上述反应达到平衡状态的是_______。
A.容器中M与N的物质的量之比为1:l
B.混合气体的密度不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗2molN的同时生成ImolM
(4)下列措施能增大反应速率的是_______(选填字母)
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com