
【题目】有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E正一价阳离子M能层电子己排满。D与B可形成离子化合物其晶胞结构如图所示。请回答下列问题: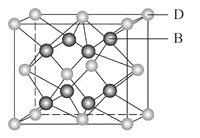
(1)E元素原子基态时的价电子排布图为___________;
(2)A2F分子中F原子的杂化类型是_______,F的氧化物FO3分子空间构型为______;
(3)CA3极易溶于水,其原因主要是________,试判断CA3溶于水后形成CA3·H2O的合理结构________(填字母代号),从氢键的形成角度回答推理依据是:___________。
(a) (b)
(b)
(4)E的晶胞常采取________堆积方式。
(5)从图中可以看出,D跟B形成的离子化合物的化学式为_________;该离子了化合物晶体的密度为ag/cm3,则晶胞的体积是_______cm3(写出表达式即可,NA表示阿伏加德罗常数的值)。
【答案】 ![]() sp3 平面正三角形 与水分子间形成氢键 b N给电子能力强,而和氧原子相连的氢原子几乎为裸露的质子,两者易形成氢键或答一水合氨电离产生铵根离子和氢氧根 面心立方最密堆积 CaF2
sp3 平面正三角形 与水分子间形成氢键 b N给电子能力强,而和氧原子相连的氢原子几乎为裸露的质子,两者易形成氢键或答一水合氨电离产生铵根离子和氢氧根 面心立方最密堆积 CaF2 ![]()
【解析】有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,则A为H元素;B是电负性最大的元素,则B为F元素;C的2p轨道中有三个未成对的单电子,则C原子核外电子排布为1s22s22p3,则C为N元素;F原子核外电子数是B与C核外电子数之和,则F原子核外电子数为9+7=16,则F为S元素;D与B可形成离子化合物,根据晶胞结构可知,晶胞中F原子数目为8,D原子数目为8×![]() +6×
+6×![]() =4,故化学式为DF2,D为+2价,D是主族元素且与E同周期,处于第四周期,E正一价阳离子M能层电子己排满,则D为Ca元素,E为Cu元素,综上所述:A为氢、B为氟、C为氮、D为钙、E为铜、F为硫;
=4,故化学式为DF2,D为+2价,D是主族元素且与E同周期,处于第四周期,E正一价阳离子M能层电子己排满,则D为Ca元素,E为Cu元素,综上所述:A为氢、B为氟、C为氮、D为钙、E为铜、F为硫;
(1)E为Cu元素,原子核外电子数为29,基态原子的电子排布式为1s22s22p63s23p63d104s1,其价电子排布图为![]() ;
;
(2)H2S分子中S原子价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论知S原子的杂化类型为sp3,S的氧化物SO3分子中S原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知三氧化硫分子空间构型为平面三角形;
(3)NH3与水分子间形成氢键,故NH3极易溶于水;O元素的电负性大于N元素的电负性,则水中的H原子为裸露的质子,两者易形成氢键或答一水合氨电离产生铵根离子和氢氧根,则形成的NH3H2O的合理结构为b;
(4)Cu为面心立方最密堆积;
(5)D跟B形成的离子化合物的化学式为CaF2;该离子化合物晶体的密度为agcm-3,该晶胞体积=![]() =
=![]() =
=![]() 。
。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】下列关于氮气的性质和用途的叙述中错误的是( )
A. 是一种很难溶于水的无色无味气体
B. 通常情况下,很难与其它物质发生化学反应
C. 从空气中分离出的氮气,可用于填充白炽灯的灯泡
D. 从空气中分离出的氮气,不能用于生产氮肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键和化合物的说法中正确的是( )
A. 化学键的形成一定伴随着电子的得失
B. 金属元素和非金属元素形成的化合物一定是离子化合物
C. 非金属元素组成的化合物一定是共价化合物
D. 含有阴离子的化合物中一定含有阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活中常见物质的俗名与化学式相对应的是( )
A. 生石灰—Ca(OH)2 B. 重晶石—BaCO3
C. 明矾—CuSO4·5H2O D. 小苏打—NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,
已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是__________。
(2)该反应中,发生还原反应的过程是_____________________。
(3)写出该反应的化学方程式,并用单线桥或双线桥标出电子转移的方向和数目________________________________________________________
(4)若反应转移了0.3mol电子,则产生的气体在标准状况下体积为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是一种难溶于水、密度约为水的密度的1.5倍、沸点为38.4℃的无色液体。如图为实绘室制备溴乙烷的装置示意图(夹持仅器已略去)。G中盛蒸馏水,实验时选用的药品有:溴化钠、95%乙醇、浓H2SO4。边反应边蒸馏,蒸出的溴乙烷用水下收集法获得。实验室制备溴乙烷的反应原理如下
NaBr+H2SO4(浓)![]() NaHSO4+HBr CH3CH2OH+HBr→CH3CH2Br+H2O
NaHSO4+HBr CH3CH2OH+HBr→CH3CH2Br+H2O
己知药品的用量:①NaBr(s)0.3mol,②浓硫酸36mL(98%、密度1.84g/cm3),③乙醇0.25mol。
可能存在的副反应有:醇在浓硫酸存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。试问答:
(1)为防止副反应的发生,向圆底烧瓶内加入药品时,还需加入适量的______。
(2)装置B的作用是:①使溴乙烷馏出,②_________。
(3)溴乙烷可用水下收集法的依据是______、_______。
(4)粗产品用水洗涤后有机层仍呈红棕色,欲除去该杂质,可加入的试剂为____(填编号)。
a.碘化钾溶液b.亚硫酸氢钠溶液c.氢氧化钠溶液
(5)本实验的产率为60%,则可制取溴乙烷______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③___________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为___________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和___________。
(4)“氧化”生成Ni2O3的离子方程式为___________。
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2 溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如右图所示,则NH4Cl的浓度最好控制为___________。

(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为 ___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com