
【题目】化学反应Na2CO3+2HCl=2NaCl+H2O + CO2↑的离子方程式是
A. CO32-+2H+ = H2O+CO2↑B. CO32-+H+=H2O+CO2↑
C. CO32-+2HCl=2Cl-+H2O+CO2↑D. Na2CO3+2H+=2Na++H2O+CO2↑
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。
①把FeO、Fe2O3先溶于足量的稀盐酸中、再通入适量的氯气则可制取FeCl3溶液。FeO、Fe2O3溶于足量的稀盐酸中,在上述溶液中通入适量的氯气时发生的反应的离子方程式为 ____________________。若要检验溶液中Fe3+存在应选用的试剂是_____________________。
②写出FeCl3溶液与金属铜发生反应的化学方程式___________________________________,当转移电子数为6.02×1024时,被氧化的物质的质量为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某物质中加入浓的氢氧化钠溶液并加热,能产生使润湿的红色石蕊试纸变蓝的气体,该物质可能是
A. MgCl2B. FeCl3C. NaClD. NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在.
(1)①氯胺(NH2Cl)的电子式为 . 可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H= .
化学键 | 键能/(kJmol﹣1) |
N﹣H | 391.3 |
Cl﹣Cl | 243.0 |
N﹣Cl | 191.2 |
H﹣Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 .
(2)用焦炭还原NO的反应为:2NO(g)+C(s)N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为(填“放热”或“吸热”)反应.
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)= .
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示: 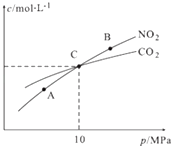
② A,B两点的浓度平衡常数关系:Kc(A)Kc(B)(填“<”或“>”或“=”).
②A,B,C三点中NO2的转化率最高的是(填“A”或“B”或“C”)点.
③计算C点时该反应的压强平衡常数Kp(C)=(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(X代表卤素原子,R代表烃基) ![]()
利用上述信息,按以下步骤从 ![]() 合成
合成 ![]() .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)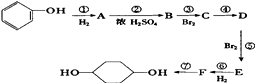
请回答下列问题:
(1)分别写出B,D的结构简式:B、D .
(2)反应①~⑦中属于消去反应的是 . (填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为: .
(4)试写出C→D反应的化学方程式(有机物写结构简式,并注明反应条件): .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)在医药方面有重要应用.下列关于 ![]() Bi和
Bi和 ![]() Bi的说法正确的是( )
Bi的说法正确的是( )
A.![]() Bi和
Bi和 ![]() Bi都含有83个中子
Bi都含有83个中子
B.![]() Bi和
Bi和 ![]() Bi互为同位素
Bi互为同位素
C.![]() Bi和
Bi和 ![]() Bi的核外电子数不同
Bi的核外电子数不同
D.![]() Bi和
Bi和 ![]() Bi分别含有126和127个质子
Bi分别含有126和127个质子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以正丁醇、溴化钠、硫酸为原料制备正溴丁烷的反应如下:
NaBr+H2SO4═HBr+NaHSO4
CH3CH2CH2CH2OH+HBr ![]() CH3CH2CH2CH2Br+H2O
CH3CH2CH2CH2Br+H2O
在圆底烧瓶中加入原料,充分振荡后加入几粒沸石,安装装置Ⅰ.加热至沸腾,反应约40min.待反应液冷却后,改装为装置Ⅱ,蒸出粗产品.部分物理性质列表如下: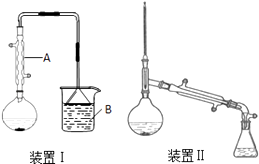
物质 | 正丁醇 | 正溴丁烷 |
沸点/℃ | 117.2 | 101.6 |
熔点/℃ | ﹣89.12 | ﹣112.4 |
密度/gcm﹣3 | 0.8098 | 1.2758 |
溶解性 | 微溶于水,溶于浓硫酸 | 不溶于水和浓硫酸 |
将所得粗产品倒入分液漏斗中,先用10mL水洗涤,除去大部分水溶性杂质,然后依次用5mL浓硫酸、10mL水、10mL饱和NaHCO3溶液、10mL水洗涤.分离出有机层,加入无水氯化钙固体,静置1h,过滤除去氯化钙,再常压蒸馏收集99~103℃馏分.
回答下列问题:
(1)仪器A的名称是 , 冷却水从A的(填“上”或“下”)口通入.
(2)在圆底烧瓶中加入的原料有:①10ml水;②7.5ml正丁醇;③10g溴化钠;④12mL浓硫酸.上述物质的加入顺序合理的是(填正确答案标号).
a.①④②③b.④①②③c.③④①②
(3)烧杯B中盛有NaOH溶液,吸收的尾气主要是(填化学式).本实验使用电热套进行加热,总共使用了次.
(4)用浓硫酸洗涤粗产品时,有机层从分液漏斗(填“上口倒出”或“下口放出”).最后一次水洗主要是洗掉
(5)制备正溴丁烷时,不直接用装置Ⅱ边反应边蒸出产物,其原因是 .
(6)本实验得到正溴丁烷6.5g,产率为(只列式,不必计算出结果).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com