
【题目】氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①CH3OH(l)+O2(g )= CO(g)+2H2O(g) △H= - 354.8 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H= -566.0 kJ·mol-1
③H2O(g) = H2O(l) △H= -44.0 kJ·mol-1
请写出甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:______________________________。
(2)某实验小组利用H2(g)、O2(g)、KOH(aq)设计成电池装置(装置Ⅰ),通过装置Ⅱ实现铁棒上镀铜。

①装置Ⅰ中,a口通入的气体为____________(填“H2”或“O2”),放电时,溶液中的K+向______极移动(填“正”或“负”),该电池负极的电极反应式为______________________。
②装置Ⅱ中,溶液c可选用________________溶液。
若电镀结束后,装置Ⅱ中Fe电极的质量改变了12.8g,则装置Ⅰ中理论上消耗氧气的体积为________L(标准状况下)
【答案】 2CH3OH(l)+3O2(g )=2 CO2(g)+4H2O(l) △H=-1451.6 kJ·mol-1 O2 正 H2-2e-+2OH-===2H2O CuSO4 2.24
【解析】(1)①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJmol-1,②2CO(g)+O2(g)═2CO2(g) △H=-566.0kJmol-1,③H2O(g)═H2O(l)△H=-44.0kJmol-1,根据盖斯定律,将①×2+②+③×4得到2CH3OH(l)+3O2(g )=2 CO2(g)+4H2O(l),所以该反应的△H=(-354.8kJ/mol)×2 +(-566.0kJ/mol) +(-44.0kJ/mol)×4=- 1451.6kJmol-1,即2CH3OH(l)+3O2(g )=2 CO2(g)+4H2O(l) △H=-1451.6kJmol-1,故答案为:2CH3OH(l)+3O2(g )=2 CO2(g)+4H2O(l)△H=-1451.6kJmol-1;
(2)①根据图示,装置I为氢氧燃料电池,装置II为电解池,通过装置Ⅱ实现铁棒上镀铜,则铁作阴极,即b为负极,则b极上通入氢气,a口通入氧气;放电时,溶液中的K+向正极移动,负极的电极反应式为H2-2e-+2OH-=2H2O,故答案为:O2;正;H2-2e-+2OH-===2H2O;
②装置Ⅱ为电镀池,实现铁棒上镀铜,溶液c可选用硫酸铜溶液,电镀结束后,Fe电极的质量改变了12.8g,为析出的铜,物质的量为![]() =0.2mol,转移0.4mol电子,则装置Ⅰ中理论上消耗氧气0.1mol,标准状况下的体积为2.24L,故答案为:CuSO4;2.24。
=0.2mol,转移0.4mol电子,则装置Ⅰ中理论上消耗氧气0.1mol,标准状况下的体积为2.24L,故答案为:CuSO4;2.24。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室用下列溶质配制一种混合溶液,已知溶液中c(K+)=c(Cl﹣)= ![]() c(Na+)=c(SO
c(Na+)=c(SO ![]() ),则其溶质可能是( )
),则其溶质可能是( )
A.KCl、Na2SO4
B.KCl、Na2SO4、NaCl
C.NaCl、K2SO4
D.KCl、K2SO4、Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如下所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题: 84消毒液
[有效成分]NaClO
[规格]1000mL
[质量分数]25%
[密度]1.19gcm﹣3
(1)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=molL﹣1 .
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制80mL含NaClO质量分数为25%的消毒液,需要称量NaClO固体的质量为g;所用到的玻璃仪器有玻璃棒、烧杯、量筒和 .
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm﹣3)的浓硫酸配制2000mL2.3molL﹣1的稀硫酸用于增强“84消毒液”的消毒能力. ①所配制的稀硫酸中,H+的物质的量浓度为molL﹣1 .
②需用浓硫酸的体积为mL.
(4)配置一定物质的量浓度的稀硫酸时,下列操作会使所配溶液物质的量浓度偏低的是 .
A.定容时俯视容量瓶刻度线
B.用量筒量取浓硫酸时俯视刻度线
C.容量瓶用蒸馏水洗涤干净后没有干燥就移入所配置溶液
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线.
E.加水时超过刻度线,用胶头滴管吸出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br﹣、SO ![]() 、Cl﹣等)来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程.
、Cl﹣等)来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程. 
研究性学习小组查寻资料得知:Br﹣被氧化剂氧化成溴.溴不易溶于水而易溶于CCl4回答以下问题:
(1)操作Ⅰ的名称为;要从橙色液体中分离出溴,所采取的操作需要的主要玻璃仪器除酒精灯和温度计外,还有 .
(2)试剂x,y,z的化学式分别为x , y , z;检验SO ![]() 已除尽的方法是 .
已除尽的方法是 .
(3)写出操作Ⅲ的具体操作步骤 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。
(1)利用下图装置电解制备NaOH,两电极区电解液分别为NaOH和NaCl溶液。
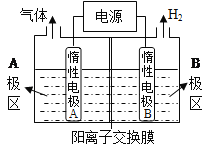
①B极区电解液为____________溶液(填化学式),A极要连接电源的_________(填“正”或“负”)极。
②阳极电极反应式为__________________________________________,电解过程中Na+向____________电极迁移(填“A”或“B”)。
③电解总反应的离子方程式是________________________________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
①若X为碳电极,为减缓铁的腐蚀,开关K应置于________处。(填“A”、“B”或“C”)

②若X为锌电极,开关K置于A处,该电化学防护法称为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. 12C、13C、14C是碳的三种同素异形体
B. H2S的电子式可表示为![]()
C. HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高
D. NaHSO4在熔融状态下不仅破坏了离子键,还破坏了共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是( )
A. 离子化合物中一定存在离子键,可能存在共价键 B. 非极性键只存在于双原子单质分子中
C. 由金属元素和非金属元素形成的化学键一定是离子键 D. NH4Cl是一种共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com