
【题目】实验室制Cl2反应4HCl(浓)+MnO2 ![]() MnCl2+ Cl2↑+2H2O,下列说法不正确的是
MnCl2+ Cl2↑+2H2O,下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每有2molHCl被氧化,转移电子的物质的量为2mol
C. 每消耗1mol MnO2,起还原剂作用的HCl消耗4mol
D. 转移电子的物质的量为1mol时,生成标准状况下Cl2的体积为11.2L
【答案】C
【解析】
由4HCl(浓)+MnO2 ![]() MnCl2+ Cl2↑+2H2O可知,HCl中Cl元素的化合价由-1价升高为0,MnO2中Mn元素的化合价由+4价降低为+2价,以此来解答。
MnCl2+ Cl2↑+2H2O可知,HCl中Cl元素的化合价由-1价升高为0,MnO2中Mn元素的化合价由+4价降低为+2价,以此来解答。
A.反应中HCl失电子为还原剂,MnO2得电子为氧化剂,选项A正确;
B.根据化合价的变化可知,反应中Cl元素的化合价由-1价升高到0价,每有2molHCl被氧化,转移电子的物质的量为2mol,选项B正确;
C.每消耗1mol MnO2,起还原剂作用的HCl消耗2mol,另一部分的HCl起到酸性的作用,选项C不正确;
D.转移电子的物质的量为1mol时,生成氯气为0.5mol,标准状况下Cl2的体积为11.2L,选项D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】在无色透明溶液中,能大量共存的离子组是( )
A.Mg2+、Na+、SO42﹣
B.K+、H+、HCO3﹣
C.Cu2+、NO3﹣、SO42﹣
D.Ba2+、NO3﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列物质所含分子数最少的是
A. 6 mol CO2 B. 6g氢气 C. 标准状况下,224L氨气 D. 含氧分子数为4NA的氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为![]() ,则两者的关系正确的是( )
,则两者的关系正确的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
【答案】D
【解析】试题分析:醋酸是弱酸,存在电离平衡,稀释促进电离。所以pH为2和3的CH3COOH溶液的浓度前者大于后者的10倍,所以中和等物质的量的氢氧化钠消耗醋酸溶液的体积应该是![]() ,答案选D。
,答案选D。
考点:考查弱电解质的电离以及外界条件对电离平衡的影响
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和方法的指导与训练,有利于培养学生的逻辑推理能力和抽象思维能力。
【题型】单选题
【结束】
22
【题目】某烷烃的各种同分异构体中,主链上有4个碳原子的只有两种结构,则含有相同碳原子数且主链上也有4个碳原子的烯烃(只含一个碳碳双键)的同分异构体有( )
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:

①检查装置气密性,往三颈烧瓶中依次加入过量锌粉、适量CrCl3溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到2.76 g[Cr(CH3COO)2]2·2H2O。
(1)装置甲中连通管a的作用是______________________。
(2)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为______________________。
(3)实验步骤③中溶液自动转移至装置乙中的实验操作为______________________。
(4)装置丙中导管口水封的目的是______________________。
(5)洗涤产品时,为了去除可溶性杂质和水分,下列试剂的正确使用顺序是________(填字母)。
a.乙醚 b.去氧冷的蒸馏水 c.无水乙醇
(6)若实验所取用的CrCl3溶液中含溶质3.17 g,则[Cr(CH3COO)2]2·2H2O(相对分子质量为376)的产率是______________________。
(7)一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝, 有“光明使者”的美誉。钨在自然界主要以钨 (+6价) 酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙(CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(FeWO4和MnWO4),钨酸(H2WO4)酸性很弱,难溶于水。
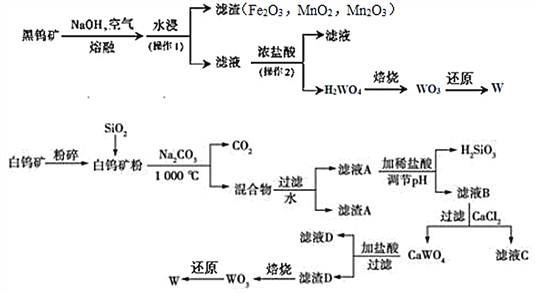
已知:①CaWO4与碳酸钠共热发生复分解反应。
②钨在高温下可与焦炭(C)反应生成硬质合金碳化钨(WC)。
(1)74W在周期表的位置是第_______周期。
(2)写出黑钨矿中FeWO4与氢氧化钠,空气熔融时的化学反应方程式________________________________;白钨矿粉与碳酸钠共热的化学反应方程式_______________。
(3)工业上,可用一氧化碳、氢气或铝还原WO3冶炼W。理论上,等物质的量的CO、H2、Al作还原剂,可得到W的质量之比为______。用焦炭也能还原WO3,但用氢气更具有优点,其理由是_____________________________________。
(4)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则T1时Ksp(CaWO4)=_________(mol/L)2。将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为_____________________________,T2时该反应的平衡常数为__________。

(5)工业上,可用电解法从碳化钨废料中回收钨。碳化钨作阳极,不锈钢作阴极,盐酸为电解质溶液,阳极析出滤渣D并放出CO2。写出阳极的电极反应式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
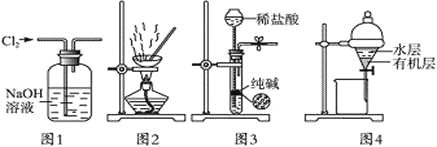
A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是
A. CO的摩尔质量为28g
B. 1mol·L-1 NaOH溶液中所含有Na+数目为NA
C. 8g NH4NO3中含有0.2mol N原子
D. 0.5mol H2所占的体积约为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g) 在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加Fe(s)的量
B.将容器的体积缩小一半
C.升高温度
D.通入水蒸气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com