
| �� |
| �� |
| �� |
| �� |
| 1 |
| 2 |
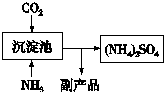
| �� |
| �� |
| �� |
| �� |
| 1 |
| 2 |
| 3 |
| 2 |
| 34g |
| 17g/mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��pH=l����Һ�У�Fe2+��Na+��S042-��NO3- |
| B��ˮ�����c��H+��=l��l0-13mol/L����Һ�У�NH4+��K+��Cl-��HCO3- |
| C��ʹ���ȱ��ɫ����Һ�У�NH4+��Al3+��NO3-��Cl- |
| D��KMn04��Һ�У�H+��Na+��SO42-��C2H5OH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������� | ��ʼʱ���������ʵ�����mol�� | ��ƽ��ʱ��ϵ�����ı仯 | ||
| X2 | Y2 | XY3 | ||
| �� | 1 | 3 | 0 | ���� 23.15 kJ |
| �� | 0.6 | 1.8 | 0.8 | Q ��Q��0�� |
| A�������١����з�Ӧ��ƽ�ⳣ����� |
| B����ƽ��ʱ������������XY3�����ʵ���Ũ�Ⱦ�Ϊ2 mol?L-1 |
| C���������з�Ӧ�ﵽƽ��ʱ�ų�������ΪQ=23.15 kJ |
| D�������������Ϊ0.20 L�����ƽ��ʱ�ų�����������23.15 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��H2O��g��=H2��g��+
| ||
| B��2H2O��l��=2H2��g��+O2��g����H=+571.6 kJ?mol-1 | ||
C��H2��g��+
| ||
| D��2H2��g��+O2=2H2O��g����H=-483.6 kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ȡ�����μ����軯����Һ |
| B��ȡ��������ˮ��CCl4�������� |
| C��ȡ����������������ȣ���ʪ���Ʒ����ֽ�������� |
| D��ȡ������������NaOHŨ��Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ�������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com