
【题目】下列说法中错误的是( )
A.根据对角线规则,铍和铝的性质具有相似性
B.在H3O+、NH4+ 和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.P4和CH4都是正四面体分子且键角都为109o28ˊ
科目:高中化学 来源: 题型:
【题目】食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯(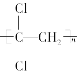 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4—CH2===CH—CH2—CH===CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是________。
A.分子式为C18H34O2
B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应
D.能使酸性KMnO4溶液褪色
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式: ___________。
(4)劣质奶粉中蛋白质含量很低。蛋白质水解的最终产物是__________________。
(5)在淀粉中加入吊白块制得的粉丝有毒。淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作、现象和结论:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍。
(1)W在周期表中的位置是第 周期第 族。
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为 。
(3)X、Y、Z三种元素组成的化合物中存在 (填“化学键”名称)。
(4)Z单质在W单质中燃烧火焰的颜色是 ;Z单质在空气燃烧生成的物质中,共价键的类型为 ;Y、Z、W形成的某种化合物类型是 化合物(填“共价”或“离子”)。
(5)X和Y形成的化合物沸点 (填“高”或“低”)于X和W形成的化合物沸点。
(6)W单质的水溶液滴入KBr溶液中的现象是 ;Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.金属的熔点和沸点都很高
B.H2O2、PCl5都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的酸性依次增强
D.H2O是一种非常稳定的化合物,这是由于氢键所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 热的纯碱溶液比冷的纯碱溶液去油污效果好
B. 盛放Na2CO3溶液的试剂瓶不能用橡胶塞
C. 将AlCl3溶液加热、蒸干、灼烧,可得到固体Al2O3
D. 铁在潮湿的环境下生锈与盐类水解无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化铝易溶于苯和乙醚,其熔点为190℃,则下列结论错误的是( )
A.氯化铝是电解质
B.固体氯化铝是分子晶体
C.可用电解熔融氯化铝的办法制取金属铝
D.氯化铝为非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断中正确的是
A. 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B. 无法确定原溶液中是否存在Cl-
C. 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D. 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质X是某新型净水剂的中间体,它可以看成由氯化铝(在180℃升华)和一种盐A按物质的量之比1:2组成。在密闭容器中加热8.75g X使之完全分解,冷却后可得到3.2 g固体氧化物B、0.448L无色气体D(体积已折算为标准状况)、4.27g混合晶体E。B溶于稀盐酸后,滴加KSCN溶液,混合液变血红色。D气体能使品红褪色。
请回答下列问题:
(1)X的化学式为 。
(2)将A固体隔绝空气充分灼烧,使其分解,生成等物质的量的B、D和另一种化合物,则A分解的化学方程式为 。
(3)将E混合晶体溶于水配成溶液,逐滴加入过量稀NaOH溶液,该过程的总反应的离子方程式为 。E混合晶体中某种物质在一定条件下能和KI固体反应,写出该方程式 。
(4)高温下,若在密闭容器中长时间煅烧X,产物中还有另外一种气体,其分子式是 。请设计实验方案验证之 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
【实验目的】制取乙酸乙酯。
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,该反应的化学方程式为________________________________________________。
【装置设计】甲、乙、丙三位同学分别设计了如下图所示三套实验装置:
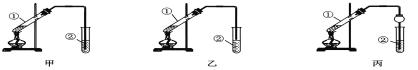
若从甲、乙两位同学设计的装置中选择一套作为实验室制取乙酸乙酯的装置,选择的装置应是__________(选填“甲”或“乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管,除了起冷凝作用外,另一重要作用是__________________________。
【实验步骤】
A.按所选择的装置组装仪器,在试管①中先加入3 mL 95%的乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸。
B.将试管固定在铁架台上。
C.在试管②中加入5 mL饱和Na2CO3溶液。
D.用酒精灯对试管①加热。
E.当观察到试管②中有明显现象时停止实验。
【问题讨论】
(1)步骤A组装好实验装置,加入样品前还应检查______________________。
(2)试管②中观察到的现象是__________________________________________。
(3)试管②中饱和Na2CO3溶液的作用是__________________________________。
饱和Na2CO3溶液________(选填“能”或“不能”)用NaOH溶液代替,其原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com