
【题目】按要求填空:
(1)Al(OH)3酸式电离方程式:___________________________________
(2)用离子方程式分析Na2CO3溶液显碱性的主要原因:___________________________________
(3)CaCO3沉淀溶解平衡方程式:_____________________________________
(4)25℃时,四种溶液 ① pH=2的H2SO4溶液、②pH=12的Ba(OH)2溶液,③pH=4的NH4Cl溶液,④pH=12的CH3COONa溶液,水电离的c(H+)之比是______________________
【答案】Al(OH)3 ![]() H+ + AlO2- + H2O CO32-+ H2O
H+ + AlO2- + H2O CO32-+ H2O ![]() HCO3-+ OH- CaCO3(s)
HCO3-+ OH- CaCO3(s) ![]() CO32-(aq)+ Ca2+(aq) 1:1:108:1010
CO32-(aq)+ Ca2+(aq) 1:1:108:1010
【解析】
⑴Al(OH)3酸式电离即电离出氢离子、偏铝酸根和水,其电离方程式:Al(OH)3 ![]() H+ + AlO2- + H2O,故答案为:Al(OH)3
H+ + AlO2- + H2O,故答案为:Al(OH)3 ![]() H+ + AlO2- + H2O。
H+ + AlO2- + H2O。
⑵Na2CO3溶液显碱性的主要原因是碳酸根水解显碱性:CO32-+ H2O ![]() HCO3-+ OH-,故答案为:CO32-+ H2O
HCO3-+ OH-,故答案为:CO32-+ H2O ![]() HCO3-+ OH-。
HCO3-+ OH-。
⑶CaCO3沉淀溶解平衡方程式:CaCO3(s) ![]() CO32-(aq) + Ca2+(aq)
CO32-(aq) + Ca2+(aq)
⑷25℃时,四种溶液 ① pH=2的H2SO4溶液,c(H+) = 1×10-2mol/L,c(OH-) = 1×10-12mol/L,水电离出的氢离子浓度c(H+) = 1×10-12mol/L,②pH=12的Ba(OH)2溶液,c(OH-) = 1×10-2mol/L,c(H+) = 1×10-12mol/L,水电离出的氢离子浓度c(H+) = 1×10-12mol/L,③pH=4的NH4Cl溶液,c(H+) = 1×10-4mol/L,c(OH-) = 1×10-10mol/L,水电离出的氢离子浓度c(H+) = 1×10-4mol/L,④pH=12的CH3COONa溶液,c(OH-) = 1×10-2mol/L,c(H+) = 1×10-12mol/L,水电离出的氢离子浓度c(H+) = 1×10-2mol/L,因此水电离的c(H+)之比是1×10-12mol/L:1×10-12mol/L:1×10-4mol/L:1×10-4mol/L = 1:1:108:1010,故答案为:1:1:108:1010。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
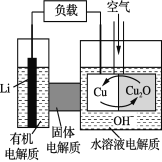
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)![]() Y(g)+Z(s),以下不能作为反应达到平衡标志的是( )
Y(g)+Z(s),以下不能作为反应达到平衡标志的是( )
A.v正(X)=2v逆(Y)B.混合气体的压强不再变化
C.混合气体的密度不再变化D.单位时间内生成lmolY的同时分解2mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B. 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C. 用0.2000 molL-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 molL-1),当pH=7时,溶液中的酸恰好完全中和
D. 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 molL-1盐酸、③0.1 molL-1氯化镁溶液、④0.1 molL-1硝酸银溶液中,Ag+浓度:④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖
B.室温下,将![]() HA溶液和
HA溶液和![]() 溶液等体积混合
溶液等体积混合![]() 忽略体积的变化
忽略体积的变化![]() 测得混合溶液的
测得混合溶液的![]() ,则混合溶液中由水电离出的
,则混合溶液中由水电离出的![]()
C.纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于![]() 时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体
时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体
D.已知![]() 的
的![]() 为
为![]() ,则将等体积的
,则将等体积的![]()
![]() 的
的![]() 溶液和
溶液和![]()
![]()
![]() 溶液混合后会有
溶液混合后会有![]() 沉淀产生
沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
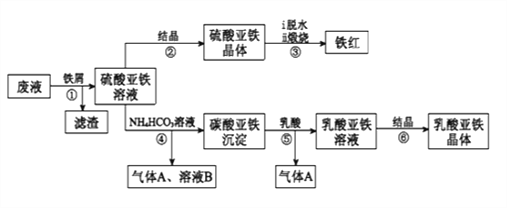
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_________________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________。
(5)步骤④的离子方程式是_________________________________________。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______________(用a表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有______________________(任写一种)。
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_____________,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为_____________mol/L。
(3)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____________________。
(4)“赶氨”时,最适宜的操作方法是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是

A. b膜是阳离子交换膜
B. A极室产生气泡并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. B极室产生的气体可使湿润的KI淀粉试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A 是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物 A~G 之间的转化关系:
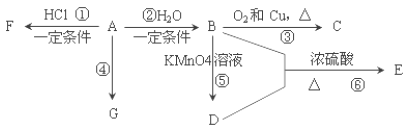
请回答下列问题:
(1)A 的官能团的名称是___________; C 的结构简式是________;
(2)E 是一种具有香味的液体, 由 B+D→E 的反应方程式为___________, 该反应类型是______________;
(3)G 是一种高分子化合物,其结构简式是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质 F(沸点 12.27°C)进行应急处理.写出由A 制 F 的化学反应方程式______________。
(5)E 的同分异构体能与 NaHCO3溶液反应,写出该同分异构体的结构简式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com