
����Ŀ��ϴú��ѡú�������ų���ú��ʯ����Ҫ��Al2O3��SiO2��Fe2O3����ռ�ô�Ƭ���أ���ɻ�����Ⱦ��ij����������ú��ʯ�Ʊ��ۺ��Ȼ����������£�
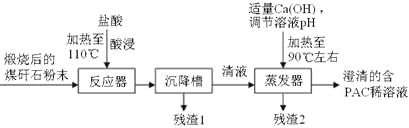
��֪���ۺ��Ȼ�����[Al2(OH)nCl6-n]m��1��n��5��m��10������ҵ����PAC����һ�����͡���Ч�������;�ˮ����
��1�������Ŀ����___________________________��ʵ����Ҫ��500mL3.0 mol��L-1�����ᣬ����ʱ����Ҫ�IJ�����������Ͳ���ձ������������______________________��
��2����m=n=2��������PAC�Ļ�ѧ����ʽ��_____________________��
��3���Ӻ�PAC��ϡ��Һ�л��PAC�����ʵ�����������_______��_________��_________��
��4��Ϊ�˷�������2����Ԫ�صĺ�����ijͬѧ��ȡ5.000g����2���Ƚ���Ԥ����ʹ��Ԫ�ػ�ԭΪFe2+����������ƿ�����Ƴ�100mL��Һ��Ȼ����ȡ25.00mL������Һ����1.000��10-2mol��L-1KMnO4����Һ�ζ������ı���Һ20.00mL����֪��ӦʽΪFe2++MnO4��+H+��Fe3++Mn2++H2O��δ��ƽ�����жϵζ��յ��������_______________________������2����Ԫ�ص���������Ϊ________________��
���𰸡���ú��ʯ�е�Al2O3��Fe2O3�ܽ⣬��SiO2���� 500mL����ƿ����ͷ�ι� 4AlCl3+2Ca(OH)2![]() [Al2(OH)2Cl4]2+2CaCl2����4AlCl3+4H2O
[Al2(OH)2Cl4]2+2CaCl2����4AlCl3+4H2O![]() [Al2(OH)2Cl4]2+4HCl�� ����Ũ�� ��ȴ�ᾧ ���� �������һ�θ��������Һʱ����Һ����dz��ɫ���ڰ�����ڲ���ɫ 4.480%
[Al2(OH)2Cl4]2+4HCl�� ����Ũ�� ��ȴ�ᾧ ���� �������һ�θ��������Һʱ����Һ����dz��ɫ���ڰ�����ڲ���ɫ 4.480%
��������
��1�������Ŀ���dz�ȥSiO2����������һ�����ʵ���Ũ�ȵ���Һ�IJ���ȷ����Ҫ��������
��2����Ӧ����AlCl3��Ca(OH)2����m=n=2�����������غ���ƽ���ɡ�
��3������Һ�л�ù���IJ�������������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
��4��KMnO4��Һ����ɫ������������ָʾ��������KMnO4��Һ����ɫ�仯�����жϵζ��յ㡣���ݵ����غ������Ԫ�صĺ�����
��1����Ϊú��ʯ����Ҫ��Al2O3��SiO2��Fe2O3�������������Ŀ�����ܽ����������������������������룻ʵ����Ҫ ��500mL3.0 mol��L-1�����ᣬ����ʱ����Ҫ�IJ�����������Ͳ���ձ������������500mL������ƿ��ʢ����Һ������ʱ�轺ͷ�ιܣ�
��2����������ͼ��֪�������������ƺ������ӳ�ȥ��ʣ����ҺΪ�Ȼ�����Һ���Ȼ������������Ƽ��ȷ�Ӧ����PAC���Ȼ��ƣ���ѧ����ʽ��4AlCl3+2Ca(OH)2![]() [Al2(OH)2Cl4]2+2CaCl2����4AlCl3+4H2O
[Al2(OH)2Cl4]2+2CaCl2����4AlCl3+4H2O![]() [Al2(OH)2Cl4]2+4HCl����
[Al2(OH)2Cl4]2+4HCl����
��3������Һ�еõ����ʵķ���������Ũ������ȴ�ᾧ�����ˣ����ԴӺ�PAC��ϡ��Һ�л��PAC�����ʵ�������������Ũ������ȴ�ᾧ�����ˣ�
��4����Ϊ�������ӵ���ҺΪdz����ɫ���������Ϊ��ɫ���ﵽ�ζ��յ�ʱ���μ�һ�θ��������Һ����ҺΪdz��ɫ���Ұ�����ڲ���ɫ�����ݵ�ʧ�����غ㣬���������ӵ�ϵ���Ǹ���������ӵ�5��������25.00mL��Һ��FeԪ�ص�������1.000��10-2mol��L-1��20��10-3L��5��56g/mol=0.056g����100mL��Һ��FeԪ�ص�������0.056g��4=0.224g�����Բ���2����Ԫ�ص���������Ϊ![]() ��100%=4.48%��
��100%=4.48%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���������ʣ���.Cu ��.NaCl���� ��.NaHSO4 ��.CO2 ��.CaO ��HCl ��.ϡH2SO4 ��. ����Ba(OH)2 ��.C2H5OH ��.NaCl��Һ��
���ڵ���ʵ��ǣ�����ţ���ͬ��_____�����ڷǵ���ʵ���_____���ܵ������______��
��2��д������������ˮ��Һ�еĵ��뷽��ʽ��
��NaHSO4 ___________________________��
��Al2(SO4)3 ________________________________��
��NH4NO3 ________________________��
��3����Ҫ��д�����з���ʽ��
��д������ͭ��Һ�еμ�����������Һ�ķ�Ӧ�����ӷ���ʽ��_____________��
��д���������ӷ���ʽCO32-��2H+��CO2����H2O��ʾ��һ����ѧ����ʽ��__________��
���𰸡��ڢۢݢޢ� �ܢ� �٢ߢ�� NaHSO4=Na++H++SO42- Al2(SO4)3=2Al3++3SO42- NH4NO3=NH4++NO3- Cu2++2OH-==Cu(OH)2�� Na2CO3+2HCl=2NaCl+CO2��+H2O����������
��������
��1����ˮ��Һ����ۻ�״̬���ܹ�������������ӵĻ������ǵ���ʣ����ڵ���ʵ���NaCl������NaHSO4��CaO��HCl������Ba(OH)2����ѡ�ڢۢݢޢࣻ��ˮ��Һ�������״̬�¶�����������������ӵĻ������Ƿǵ���ʣ����ڷǵ���ʵ���CO2��C2H5OH����ѡ�ܢ���������ƶ����ӻ����ӵ����ʿ��Ե��磬�ܵ������Cu��ϡH2SO4������Ba(OH)2��NaCl��Һ����ѡ�٢ߢ�⣻��2����NaHSO4��ˮ��Һ�еĵ��뷽��ʽΪNaHSO4=Na++H++SO42-����Al2(SO4)3��ˮ��Һ�еĵ��뷽��ʽΪAl2(SO4)3=2Al3++3SO42-����NH4NO3��ˮ��Һ�еĵ��뷽��ʽΪNH4NO3=NH4++NO3-����3��������ͭ��Һ�еμ�����������Һ����������ͭ�����������ƣ���Ӧ�����ӷ���ʽΪCu2++2OH-==Cu(OH)2�������������ӷ���ʽCO32-��2H+��CO2����H2O��ʾ��һ����ѧ����ʽ������Na2CO3+2HCl��2NaCl+CO2��+H2O��
�㾦����������ˮ��Һ�л������ۻ�ʱ�����ܷ�������������������ǵ���ʵ��������ݣ��ܷ�����ʵ�����ݡ�����ܵ�������ʲ�һ���ǵ���ʣ���ʯī������ʱ�����һ���ܵ��磬��NaCl���塣
�����͡������
��������
27
����Ŀ��Ϊ̽���������Ļ������һЩ��ѧ���ʣ�ijѧ��ʵ��С�����������ʵ�顣
��1����A��B��Һ�зֱ���뼸��KSCN��Һ����Һ����ɫA________��B____________��
��2��д�������������йط�Ӧ�Ļ�ѧ����ʽ��
Fe2O3��A_______________________��A��B____________________________��
��3��B��C�ɿ�����������___________________________________________��
��4����A�ı�����Һ�����ˮ�в����ϼ��ȣ����Ƶ�_______________���壻������ͨ���ý���ʱ���ɿ���һ�������ġ�ͨ·�������������Ϊ___________ЧӦ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȩ�����ķ����кܶ࣬��������Ferrozine�������Ƚϸߡ��ⶨԭ��Ϊ��ȩ����������ԭ��Ag��������Ag��Fe3��������Ӧ����Fe2+��Fe2+������(Ferrozine)�γ���ɫ����ͨ���ⶨ����ȼ������ȩ�ĺ�����ijѧϰС����ȴ�ԭ���������װ�òⶨ��װ�����ڿ����м�ȩ�ĺ������г�װ����ȥ����

��֪����ȩ�ܱ�������Һ��������CO2������þ��ˮ��Ӧ�ų�NH3��ëϸ���ھ�������1 mm����ش��������⣺
(1)Aװ���з�Ӧ�Ļ�ѧ����ʽΪ___________���ñ���ʳ��ˮ����ˮ�Ʊ�NH3��ԭ����___________________��
(2)B��װ��AgNO3��Һ������B������Ϊ________��
(3)������Һ���Ʊ����ر�K1��K2����K3����______��ʹ����ʳ��ˮ��������Բ����ƿ�У����۲쵽B�а�ɫ����ǡ����ȫ�ܽ�ʱ��________��
(4)���ڿ����м�ȩ�����IJⶨ��
������ˮԡ����B����K1���������������������Ҷ˳鵽����ˣ�����1 L���ڿ������ر�K1������������______________�����ظ���������3�Ρ�ëϸ�ܵ�������__________��
��������B�г�ַ�Ӧ�����Һ�м���ϡ���������ҺpH=1���ټ�������Fe2(SO4)3��Һ����ַ�Ӧ�������������ຣ�Fe2���������γ���ɫ���ʣ���562 nm���ⶨ����ȣ��������Fe2+1.12 mg�������м�ȩ�ĺ���Ϊ____mg��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ���ᱡ�ɴ���(![]() )���ܷ���ˮ�⡢��������ȥ��Ӧ
)���ܷ���ˮ�⡢��������ȥ��Ӧ
B. ��ȩ�ͱ�ϩȩ(![]() )����ͬϵ�������������ַ�Ӧ��IJ���Ҳ����ͬϵ��
)����ͬϵ�������������ַ�Ӧ��IJ���Ҳ����ͬϵ��
C. ���ۺ���ά�����������ȫˮ���IJ��ﶼ��������
D. CH3COOCH2CH3��CH3CH2COOCH3��Ϊͬ���칹�壬1H��NMR����ʾ���߾������ֲ�ͬ����ԭ����������ԭ�ӵı�����ͬ���ʲ�����1H��NMR������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ���ѽ�õ�����ϩ�� 1��3-����ϩΪԭ�ϣ��������з�Ӧ�ϳɸ߷��ӻ����� H�������ʿ����������Բ�����άΪ���ϵ���ǿ���ϣ��׳Ʋ����֣���

�밴Ҫ����գ�
(1)д�����з�Ӧ�ķ�Ӧ���ͣ���Ӧ��____________ ����Ӧ�� _______________����Ӧ��_____________________
(2)��Ӧ�ڵĻ�ѧ����ʽ�� ____________________
(3) ��Ӧ�ۡ�������һ��Ӧ���� HCl �ӳɣ��÷�Ӧ��__________���Ӧ��ţ��������һ����Ӧ��Ŀ����_______________________������ C �Ľṹ��ʽ��____________________ ��
(4)��Ӧ��Ļ�ѧ����ʽ�� _______________
(5)д���� G ������ͬ�������Ŀ�Ĺ����ŵ�ͬ���칹�壺_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г�������֮���һЩ��Ӧ��ϵ�����в��ֲ���δд����������X�ǹ��壬B��G��Һ�壬�����Ϊ���塣������ͼ��ϵ�ƶϣ�

(1)д����ѧʽ��X_______��A________��B_______��
(2)ʵ�����ռ�����D��F�ķ���������_______����________����
(3)д��C��E�Ļ�ѧ����ʽ��____________��
(4)��д��A��E��Ӧ����D�Ļ�ѧ����ʽ��_______________
(5)��������A�ķ�����������________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ�İ뵼����ϣ�Ӧ���ں��պ����ء�����ͨѶ������һ���ᴿ���������Ʒ����Ҫ��GeO2��As2O3���Ĺ������£�
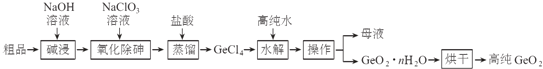
��֪���١�����������еķ�ӦΪ��
GeO2+2NaOH=Na2GeO3+H2O
As2O3+2NaOH=2NaAsO2+H2O
�ڡ������������еķ�ӦΪ��Na2GeO3+6HCl=2NaCl+GeCl4+3H2O
��GeCl4���۵�Ϊ-49.5����AsCl3��GeCl4�ķе�ֱ�Ϊ130.2����84����
��1�����ԭ������Ϊ32������Ԫ�����ڱ��е�λ��Ϊ�� ______ ���� ______ �壮
��2���������������Ĺ����ǽ�NaAsO2����ΪNa3AsO4���䷴Ӧ����ʽΪ�� ______ ��
��3����ͳ���ᴿ�����ǽ���Ʒֱ�Ӽ���������������ȱ���� ______ ��
��4����ҵ�������������ص��豸�� ______
A������ B��������ȡ�� C�������� D����ѹ���˻�
��5����ˮ��������ʱ�����Ļ�ѧ��Ӧ����ʽΪ ______ ����ˮ��������ʱ���ֽϵ��¶���������߲��ʣ�������ܵ�ԭ���� ______ ����һ�����ɣ���
��6����1�ֶ��������Ʒ��������30%�����ᴿ��0.745�ֵĸߴ����������Ʒ���������ѳ���Ϊ ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ΪN��R2����������ΪA����ng����ͬ��̬�������������������ʵ���Ϊ�� ��
A.![]() (A+N-10)molB.
(A+N-10)molB.![]() (A-N+6)mol
(A-N+6)mol
C.��A-N+2��molD.![]() (A-N+8)mol
(A-N+8)mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ũ�������Ե���������ȷ����
A. Ũ���������ˮ�ԡ���ˮ�Ժ�ǿ�����Ե�����
B. Ũ���������������е�ˮ�����������������������������ĸ����
C. Ũ����������չ����е�ʪ��ˮ���ᾧˮ�����еĽᾧˮ
D. �ڷ�ӦC12H22O11![]() 12C��11H2O��Ũ��������ˮ��
12C��11H2O��Ũ��������ˮ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com