
����Ŀ�����ӹ�ҵ����FeCl3��Һ��ʴ��Ե���ϵ�ͭ��������ӡˢ��·�塣�Ӹ�ʴ��Һ(��Ҫ��FeCl3��FeCl2��CuCl2 )�л���ͭ�������»��FeCl3��Һ����Һ�����������£�

��1������(��)���������� ��____________��
��2������B����Ҫ����_________������D��______________��
��3��д������(��)������FeCl3�Ļ�ѧ����ʽ____________________��
��4������(��)�У�����������H2O2Ҳ�ܴﵽͬ����Ŀ�ģ�д��H2O2��Fe2+����ΪFe3+�����ӷ���ʽ:_______________________��
���𰸡����� Cu��Fe H2 2FeCl2+Cl2��2FeCl3 2Fe2++H2O2+2H+��2Fe3++2H2O
��������
�Ӹ�ʴ��Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ�������̿�֪��Ӧ���������Fe���Ȼ������Ȼ�ͭ��Ӧ�����Ȼ�������ͭ�����˽��з��룬����ҺAΪFeCl2������B�к�Fe��Cu���ӹ������ᣬ���ܽ⣬�����Ȼ����������������˵õ�����Cu����ҺC�к�FeCl2��HCl��Ϊ���������ʣ������Ļ�����ȫ��ת��ΪFeCl3��Һ����ͨ���������������������ݴ˽��
�������Ϸ�����֪��ҺAΪFeCl2������B�к�Fe��Cu����ҺC�к�FeCl2��HCl������DΪ��������
��1�����裨���з�����Һ�ͳ����IJ��������ǹ��ˣ�
��2�������Ȼ�ͭ�����û���Ӧ�����Ȼ�������ͭ����Ӧ�����������������̷�����֪����B�к����������Ͳ�����ͭ������B�м������ᣬ�������ᷴӦ�����������������D��������
��3����������ǿ�����ԣ�ͨ��Cl2���Ȼ�����ȫ��ת��ΪFeCl3��������Ӧ�ķ���ʽΪ2FeCl2+Cl2��2FeCl3��
��4��˫��ˮҲ���������ԣ�H2O2��Fe2+����ΪFe3+�����ӷ���ʽΪ2Fe2++H2O2+2H+��2Fe3++2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѱ���Ϊ��21���ͽ�����
(1)��ҵ�����ѿ�ʯ(��FeTiO3����FeO��Al2O3��SiO2������)�������������Ƶ�TiO2��
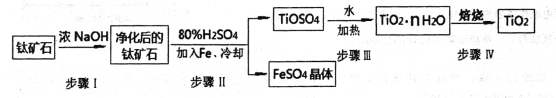
���У����������ӦΪ��2H2SO4+FeTiO3=TiOSO4+FeSO4+2H20
������I�����Ļ�ѧ����ʽ��______________________________��������FeSO4��������ˮ���������ɺ����õĹ�����_________________
�����������������Ti4+����Һ��ˮ���Ƶ�TiO2��nH2O,��÷�Ӧ�����ӷ���ʽΪ_________________________________________________
(2)������TiO2ͨ���������ַ����Ʊ������ѣ�
����һ����TiO2��������ʯī������������CaOΪ���Һ����̿�������۳أ����TiO2�Ƶ��ѣ������������ķ�Ӧ��______________________________________��
��������ͨ�����·�Ӧ�Ʊ�������
��TiO2(s)+2Cl2(g) ![]() TiCl4(g)+O2(g) ��H=+151 KJ/mol
TiCl4(g)+O2(g) ��H=+151 KJ/mol
��TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
��ʵ�������У����ڷ�Ӧ�ٹ����м���̼����˳���Ƶ�TiCl4����ԭ����_________________________��______________________________________________��(������)
(3)����֪��C(s)+O2(g)=CO2(g) ��H=-394 KJ/mol,���ɹ���TiO2������C��Cl2��Ӧ��ȡ��̬TiCl4���Ȼ�ѧ����ʽΪ______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���ˮ��Һ��1 mol Cl����ClOx��(x��1��2��3��4)������(kJ)��Դ�С��ͼ��ʾ�������й�˵����ȷ����
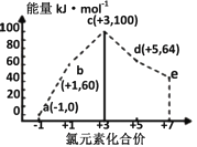
A. a��b��c��d��e�У�c���ȶ�
B. b��a��c��Ӧ�Ļ��Ϊ��Ӧ������������������
C. b��a��d��Ӧ���Ȼ�ѧ����ʽΪ��3ClO��(aq)��ClO3��(aq)��2Cl��(aq)��H����116 kJ��mol��1
D. һ���¶��£�Cl2��NaOH��Һ��Ӧ���ɵIJ�����a��b��d����Һ��a��b��d��Ũ��֮�ȿ���Ϊ11��1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100 mL 0.1 mol/L NH4Cl��Һ�м����������ʡ��йؽ�����ȷ����
��������� | ���� | |
A | 100 mL0.1 mol/L���� | ��Һ��2c(NH4+)�� c(Cl��) |
B | 0.01 mol Na2O2���� | ��Ӧ��ȫ����ҺpH����c(Na+)�� 2c(Cl��) |
C | 100 mL H2O | ��ˮ�������c(H+)��c(OH��)���(����������) |
D | 100 mL 0.1 mol/L��ˮ | ��Һ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʵ�������������ȷ���ǣ� ��
A.���ʵ����ǹ��ʵ�λ�����߸�����������֮һ
B.���ʵ����DZ�ʾ�������������Ӷ��ٵ�һ��������
C.���ʵ������÷���n��ʾ���䵥λ��Ħ��(mol)
D.���ʵ�����������ʾ���ʵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��������������������ˮ�����������ʵ���Һ�������������ҩƷ���ʵ��ǣ� ��
A.NaOHB.AgNO3C.Na2CO3D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I����֪����ӦaA(g)��bB(g)��![]() ��cC(g)��ij�¶��£��� 2 L ���ܱ�������Ͷ��һ������A��B��������������ʵ���Ũ����ʱ��仯��������ͼ��ʾ��
��cC(g)��ij�¶��£��� 2 L ���ܱ�������Ͷ��һ������A��B��������������ʵ���Ũ����ʱ��仯��������ͼ��ʾ��
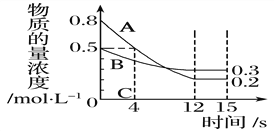
��1�����ⶨǰ4 s��v(C)��0.05 mol��L��1��s��1����÷�Ӧ�Ļ�ѧ����ʽΪ_______________________��
��2����������Ӧ�ֱ��ڼס��ҡ���������ͬ���ܱ������н��У���ͬһ��ʱ�������������еķ�Ӧ���ʷֱ�Ϊ�ף�v(A)��0.3 mol��L��1��s��1�� �ң�v(B)��0.12 mol��L��1��s��1�� ����v(C)��9.6 mol��L��1��min��1����ס��ҡ������������з�Ӧ�����ɿ쵽����˳��Ϊ__________________���üס��ҡ�����ʾ����
��: ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������100 mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų�������(����������ۺϳɱ�״��)��ʵ���¼���(�ۼ�ֵ)��
ʱ��/min | 1 | 2 | 3 | 4 | 5 | 6 |
�������/mL | 50 | 120 | 224 | 392 | 472 | 502 |
��3����һʱ��η�Ӧ�������__(��0��1��1��2��2��3��3��4��4��5��5��6 min����ͬ)��ԭ����_______________________________________________________
��4�������Ӧ̫���ң�Ϊ�˼�����Ӧ���ʶ��ֲ����ٲ����������������������зֱ����������������Һ������Ϊ���е���__________(����ĸ)
A.CH3COONa ������B.NaNO3��Һ����������C.KCl��Һ ������ D.Na2CO3��Һ
��5������˵������֤��H2(g)��I2(g)![]() 2HI(g)�Ѵ�ƽ��״̬����______________________
2HI(g)�Ѵ�ƽ��״̬����______________________
A����λʱ��������n mol H2��ͬʱ������n mol HI
B��һ��H��H�����ѵ�ͬʱ������H��I������
C���¶Ⱥ����һ��ʱ�����������ɫ���ٱ仯
D����Ӧ����v(H2)��v(I2)��![]() v(HI)
v(HI)
E���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯
F���¶Ⱥ����һ��ʱ�����������ܶȲ��ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5L���ܱ������н������·�Ӧ��4NH3+5O2��4NO+6H2O������Ӻ���ȴ�����£����NO�����ʵ���������0.3mol����˷�Ӧ��ƽ����Ӧ������(X)Ϊ�� ��
A. ��(H2O)=0.12mol��L-1��min-1B. ��(O2)=0.30mol��L-1��min-1
C. ��(NO)=0.008mol��L-1��s-1D. ��(NH3)=0.002mol��L-1��s-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com