
�����̿���Ҫ�ɷ�ΪMnO2)�Ʊ�KMnO4��ʵ�����̿ɱ�ʾ���£�
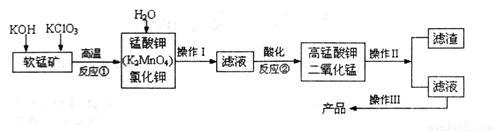
(1)�������������____________��
(2)��ѭ�����õ�����____________(�ѧʽ����
(3)��Ӧ�ڵIJ����У����������뻹ԭ��������ʵ���֮����______��
(4)��Ӧ���С��ữ��ʱ����ѡ���������е�______(����ĸ��ţ�
A��ϡ���� B��ϡ���� C��ϡ����
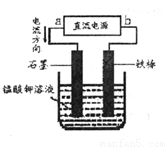
(5)����������ҺҲ���Եõ�������أ���������ӦʽΪ��2H2O+2e-=2OH-+H2��������ͼ��b��____________�������ص�������Ӧʽ��____________�������������ռ���2.24L H2 (��״��������õ������� ��____________�ˡ�(��ʾ�������ӷŵ�˳��MnO42->OH-��
��16�֣�
��1������ ��2�֣�
��2��MnO2 ��2�֣�
��3��2:1 ��2�֣�
��4��A ��2�֣�
��5���� ��2�֣���MnO42-��e-=MnO4- ��3�֣���31.6 ��3�֣�
��������
����������������������Ĺؼ���Ҫ���������ʲô���ʣ�����ʲô��Ӧ����η���ȣ�ͨ������������Ҫ�ܹ���һ�����յ�����ת��Ϊ���ʵ����̡���һ����KOH��KClO3��MnO2��Ӧ���õ�K2MnO4���Ӷ�����д����Ӧ����ʽΪ6KOH+3MnO2+KClO3=3K2MnO4+KCl+3H2O��Ȼ�����ˮ�ܽ������������ʣ��õ�K2MnO4��KCl���ڶ���������Һ�ữ���õ�������غͶ������̣�Ϊһ�绯��Ӧ���̴�+6��Ϊ+7��+4����Ӧ����ʽΪ3MnO42-+4H+=2MnO4-+MnO2+2H2O��ͨ�����˷���MnO2���������Һ�����յõ���Ʒ������������MnO2����ѭ�����á�
��4����������������������ǿ�����ԣ�����ʹ�����ᣨ���л�ԭ�ԣ���
��5����Ϊ���Ե�⣬����û�в��뷴Ӧ�����������븺����������������������Ӧ�������ʧ�������ɸ�����������ݵ��ӵ�ʧ�غ���Խ�����ؼ��㡣
���㣺�Թ�������Ϊ������������������ԭ��Ӧ����ѧʵ�������������ѧ���㡢�绯ѧ����֪ʶ��������ݡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
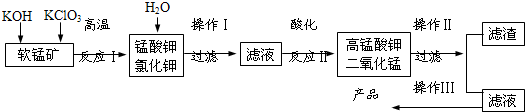
ʵ���ҿ������̿���Ҫ�ɷ�ΪMnO2���Ʊ�KMnO4���������£����̿����������KOH��KClO3�ڸ����·�Ӧ����������أ�K2MnO4����KCl����ˮ�ܽ⣬��ȥ��������Һ�ữ��K2MnO4ת��ΪMnO2��KMnO4����ȥMnO2������Ũ����Һ���ᾧ�õ�����ɫ����״KMnO4����ش�
��1�����̿��Ʊ�K2MnO4�Ļ�ѧ����ʽ��
��������������������������������������������������������������������������������
��2��K2MnO4�Ʊ�KMnO4�����ӷ���ʽ��������������������������������������������
��3������2.5g���̿�MnO280������������ʵ�飬����KMnO4�����۲�����
��4��KMnO4�����ȵľ������ữ��Na2C2O4��Ӧ����Mn2+��CO2���÷�Ӧ�Ļ�ѧ����ʽ������������ ������������������
��5�������Ƶõ�KMnO4��Ʒ0.165g��ǡ����0.335g��Na2C2O4��Ӧ��ȫ�������KMnO4�Ĵ��ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ���ҿ������̿���Ҫ�ɷ�ΪMnO2���Ʊ�KMnO4���������£����̿����������KOH��KClO3�ڸ����·�Ӧ����������أ�K2MnO4����KCl����ˮ�ܽ⣬��ȥ��������Һ�ữ��K2MnO4ת��ΪMnO2��KMnO4����ȥMnO2������Ũ����Һ���ᾧ�õ�����ɫ����״KMnO4��
��ش�
(1�����̿��Ʊ�K2MnO4�Ļ�ѧ����ʽ��������������������������������������
(2��K2MnO4�Ʊ�KMnO4�����ӷ���ʽ��������������������������������������������
(3������2.5g���̿�MnO280������������ʵ�飬����KMnO4�����۲�����
(4��KMnO4�����ȵľ������ữ��Na2C2O4��Ӧ����Mn2+��CO2�÷�Ӧ�Ļ�ѧ����ʽ��
����������������������������������������������������������������������
(5�������Ƶõ�KMnO4��Ʒ0.165g��ǡ����0.335g��Na2C2O4��Ӧ��ȫ�������KMnO4�Ĵ��ȡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com