
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
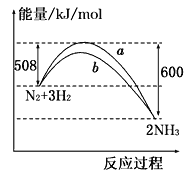
A. 该反应的热化学方程式为:N2 + 3H2 ![]() 2NH3, △H = -92kJ·mol-1
2NH3, △H = -92kJ·mol-1
B. 在温度体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为92kJ
C. b曲线是加入催化剂时的能量变化曲线
D. 加入催化剂, 该化学反应的ΔH不改变
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示。其中电解产生的H2O2与Fe2+发生Fenton反应生成的羟基自由基(·OH) 能氧化降解有机污染物。下列说法正确的是

A. 电源的X极为正极
B. 与电源Y相连电极的电极反应式为H2O+e-=H++·OH
C. Fenton反应: H2O2+Fe2+=Fe(OH)2++·OH
D. 每消耗22.4L O2 (标准状况),整个电解池中理论上可产生2mol·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 弱酸酸式盐NaHB在水溶液中水解:HB–+H2O ![]() H3O++B2–
H3O++B2–
B. 硫化钠水解: S2- + 2H2O = H2S↑+2OH-
C. 碳酸钠溶液显碱性:CO32-+H2O ![]() HCO3-+OH-
HCO3-+OH-
D. 制备氢氧化铁胶体:Fe3+ +3H2O ![]() Fe(OH)3(胶体) + 3H+
Fe(OH)3(胶体) + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4气态分子。N4分子结构如图所示,已知断裂1molN-N吸收l67KJ的热量,生成lmol N![]() N放出942KJ热量。
N放出942KJ热量。
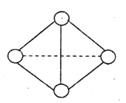
(1)试写出由N4气态分子变成N2气态分子的热化学方程式:_____________________。
(2)某盐N2H6Cl2的性质与NH4Cl类似,是离子化合物,其水溶液因分步水解而呈弱酸性。
①N2H6Cl2显酸性原因(用离子方程式表示)__________________________。
②写出足量金属镁加入盐N2H6Cl2的溶液中产生H2的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:

(1)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______(填“甲”或“乙”)中。
(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)。判断到达滴定终点的实验现象是_____________________________________
(3)右上图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______ mol·L-1。
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关该有机物的说法中正确的是

A. 能和碳酸钠溶液反应的官能团有2种
B. 1mol该有机物最多能与2molH2发生加成
C. 与![]() 互为同分异构体
互为同分异构体
D. 既可以发生取代反应又可以发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中我们常用到铝制餐具。铝在空气中稳定存在的原因是( )
A.铝能产生铝热反应B.铝的化学性质不活泼
C.常温下铝不能与氧气反应D.铝表面能形成致密的氧化膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡: H2O![]() H++ OH-ΔH > 0 ,下列叙述正确的是
H++ OH-ΔH > 0 ,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-) 降低
D. 向水中加入AlCl3固体,平衡逆向移动,c(OH-) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:
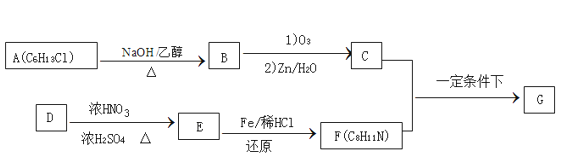
已知以下信息:
①
②1 mol B经上述反应可生2 mol C,且C不能发生银镜反应
③D属于单取代芳烃,其相对分子质量为106
④核磁共振氢谱显示F苯环上有两种化学环境的氢
⑤![]()
回答下列问题:
(1)由A生成B的反应类型为____________
(2)D的化学名称是____________,由D生成E的化学方程式为: ______
(3)G的结构简式为____________
(4)F的同分异构体中含有苯环的还有____种(不考虑立体异构)。其中核磁共振氢谱中有4组峰,且面积比为6:2:2:1的是_______。(写出其中的一种的结构简式)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。

反应条件1所选择的试剂为__________;反应条件2所选择的试剂为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com