
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示。其中电解产生的H2O2与Fe2+发生Fenton反应生成的羟基自由基(·OH) 能氧化降解有机污染物。下列说法正确的是

A. 电源的X极为正极
B. 与电源Y相连电极的电极反应式为H2O+e-=H++·OH
C. Fenton反应: H2O2+Fe2+=Fe(OH)2++·OH
D. 每消耗22.4L O2 (标准状况),整个电解池中理论上可产生2mol·OH
科目:高中化学 来源: 题型:
【题目】中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料转化成葡萄糖内酯并获得能量。下列说法正确的是( )

A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. b极的电极反成为:MnO2+2H2O+2e-=Mn2++4OH-
D. 当消耗0.01mol葡萄糖时,电路中转移0.02mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中没有沉淀产生
D. 该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据要求回答下列问题。

(1)十种元素中化学性质最不活泼的元素是________(填元素符号)。
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是________(填化学式)。
(3)I元素跟A元素形成化合物的电子式是_____________。
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入少量无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到乙试管中有明显现象时停止实验。试回答:

(1)试管乙中观察到的现象是______________________。
(2)液体混合加热时液体容积不能超过其容积_____,本实验反应开始时用小火加热的原因是__________;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
(3)试管甲中加入浓硫酸的目的是__________。
(4)该实验中长导管的作用是_______,其不宜伸入试管乙的溶液中,原因是________。
(5)试管乙中饱和Na2CO3的作用是______________________________________。
(6)写出试管甲中发生反应的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某反应的微观示意图,下列说法不正确的是( )

A. 反应前后各元素原子个数不变
B. 该反应说明分子在化学变化中可以再分
C. 该反应的生成物只有一氧化碳和氢气
D. 反应前后各元素化合价均不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Ag+ Na+ |
阴离子 | NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27g。常温下各烧杯中溶液的pH与电解时间(t)的关系如图。据此回答下列问题:

(1)M为电源的__________极(填“正”或“负”)。
(2)写出甲烧杯中反应的化学方程式____________________。
(3)有人设想用图一所示原电池为直流电源完成上述电解。则锌电极相当于直流电源的_________(填“M”或“N”)极。

(4)有人设想用图二所示装置做直流电源,不仅可以完成电解也能将气体SO2转化为重要化工原料。该设想中负极的电极反应式为 __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
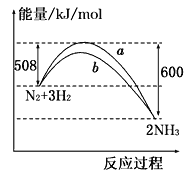
A. 该反应的热化学方程式为:N2 + 3H2 ![]() 2NH3, △H = -92kJ·mol-1
2NH3, △H = -92kJ·mol-1
B. 在温度体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为92kJ
C. b曲线是加入催化剂时的能量变化曲线
D. 加入催化剂, 该化学反应的ΔH不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com