
【题目】下列有关仪器使用方法或实验操作正确的是![]()
A.洗净的锥形瓶和容量瓶可以放进烘箱烘干
B.酸式滴定管装标准溶液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染等方面应用广泛。利用SO2生产Na2S2O5的工艺如图:
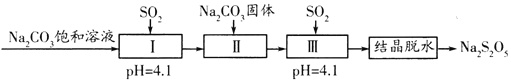
资料:Na2S2O5通常是由NaHSO3过饱和溶液经结晶脱水制得,下列说法正确的是( )
A.Na2S2O5是Na2SO3和SO2的混合物
B.pH=4.1时,I中主要反应的化学方程式为Na2CO3+SO2=Na2SO3+CO2
C.加入Na2CO3固体的目的是调节pH,促进Ⅲ中SO2的再吸收
D.“结晶脱水”过程中反应的化学方程式为2NaHSO3=Na2S2O5+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸香叶酯是一种食品香料,可由香叶醇与甲酸发生酯化反应制得。下列说法正确的是( )
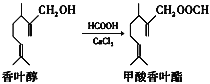
A.香叶醇的分子式为C11H18O
B.香叶醇在浓硫酸、加热条件下可发生消去反应
C.1 mol甲酸香叶酯可以与3 mol H2发生加成反应
D.甲酸香叶酯与新制的Cu(OH)2悬浊液共热可生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置分别完成相关实验,能达到实验目的是![]()
A | B | C | D |
制备并收集氨气 | 比较 | 用NaOH溶液滴定锥形瓶中的盐酸溶液 | 制备乙酸乙酯 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定人体血液中Ca2+的含量,设计了如下方案:
![]()
有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4 K2SO4+2MnSO4+10CO2↑+8H2O若血液样品为15mL,滴定生成的草酸消耗了0.001mol·L-1的KMnO4溶液15.0mL,则这种血液样品中的含钙量为
A.0.001mol·L-1B.0.0025mol·L-1 C.0.0003mol·L-1D.0.0035mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为不同温度下水的电离平衡曲线,已知pOH=lgc(OH),下列说法正确的是

A. T1和T2的关系是:T1>T2
B. KW的关系是:B>C>A=D=E
C. A点到D点:加入少量酸可实现
D. T2时:pH=2的硫酸与pH=12的NaOH溶液等体积混合,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的是( )
实验目的 | 实验操作 | |
A | 除去 | 向含有少量 |
B | 检验溶液中是否含有 | 取少量溶液于试管中,先加入 |
C | 比较HCl和 | 用pH试纸测定浓度均为 |
D | 验证 | 将硫酸酸化的 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁单质及化合物与我们的生产、生活紧密相关。
(1)Fe3+的基态核外价电子排布式为______,应用原子结构比较Fe与同周期的Mn第三电离能(I3)的大小:I3(Mn)_______I3(Fe)(填>、<、=)。理由是_______。
(2)Fe、Fe2+、Fe3+可以与CO、SCN-、CN-、H2NCONH2(尿素)等多种配体形成很多的配合物。
①配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示:

下列关于Fe(CO)5说法不正确的是________。
A.Fe(CO)5是分子晶体
B.Fe(CO)5中Fe原子的配体与C22-互为等电子体
C.Fe(CO)5中σ键与π键之比为1:1
D.Fe(CO)5=Fe+5CO反应中没有新化学键生成
②CN-的电子式为__________。
③H2NCONH2(尿素)中N、C原子的杂化方式分别为__________、__________,
组成尿素的4种元素的第一电离能由大到小的顺序为__________,1 mol H2NCONH2(尿素)分子中含有σ键的数目为__________。
(3)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3C,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是________。
(4)FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置的Fe或者b位置的Fe,形成Cu替代型产物Fe(x-n)CunNy,FexNy转化为两种Cu的替代型产物的能量变化如图2所示,其中相对不稳定的Cu替代型产物的化学式为__________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com